名校
解题方法
1 . 物质的大小会对其性质有极大影响。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
资料: 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。
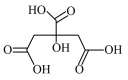
①在制备过程中,存在如下反应,已知产物 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) _______ 。
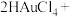 □
□ →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl
②柠檬酸钠的作用是_______ ,如果一段时间后的液体仍为黄色,则可以_______ (填操作)来检验是否生成纳米金。
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸( )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物_______ ,证明猜想成立。
②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是_______ 。
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。

结合图4和上述实验,你可以得出什么推论?_______ 。
(3)综合上述内容,你对物质有了哪些更深入的认识?_______ 。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的
 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。| 纳米金颗粒大小(nm) | 颜色 |
| 2~5 | 黄 |
| 10~20 | 红 |
| 30~80 | 紫 |
 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。①在制备过程中,存在如下反应,已知产物
 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) 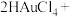 □
□ →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl②柠檬酸钠的作用是
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸(
 )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的
 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。
结合图4和上述实验,你可以得出什么推论?
(3)综合上述内容,你对物质有了哪些更深入的认识?
您最近一年使用:0次
2022-05-31更新
|
261次组卷
|
2卷引用:北京市东城区第五中学2022届高三三模化学试题
2 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4中氯元素的化合价是_______ ,具有_______ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做______ (填“还原剂”或“氧化剂”)。
③ NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是_______ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

① 根据实验目的,将虚线框中的装置补充完整并标出所用的试剂_______ 。
② 装置C中观察到的现象是_______ ,反应的化学方程式是_______ 。
③ 装置D的作用是吸收未反应的CO2便于O2的检验。吸收CO2的离子方程式是_____ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4中氯元素的化合价是
② Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做
③ NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

① 根据实验目的,将虚线框中的装置补充完整并标出所用的试剂
② 装置C中观察到的现象是
③ 装置D的作用是吸收未反应的CO2便于O2的检验。吸收CO2的离子方程式是
您最近一年使用:0次
2019-02-19更新
|
398次组卷
|
4卷引用:【区级联考】北京市朝阳区2018-2019学年高一上学期期末考试化学试题
名校
解题方法
3 . 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下:已知: (橙色)+ H2O⇌
(橙色)+ H2O⇌ (黄色)+ 2H+
(黄色)+ 2H+
(1)配制溶液
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:__ 。
(2)进行实验iii和iv:
②用离子方程式解释iii中现象:__ 。
(3)继续进行实验v:
③实验vi的目的是__ 。
④用化学平衡移动原理解释v中现象:__ 。
⑤根据实验iii~v,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__ 。
⑥向实验v所得黄色溶液中滴加__ ,产生的现象证实了上述推测。
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,电压为a。
b.向U形管左侧溶液中滴加3滴浓硫酸后,电压增大了b。
⑦上述实验说明:__ 。
⑧有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论。该实验方案是__ ,测得电压增大了d(d < b)。
 (橙色)+ H2O⇌
(橙色)+ H2O⇌ (黄色)+ 2H+
(黄色)+ 2H+(1)配制溶液
| 序号 | 操作 | 现象 |
| i | 配制饱和Na2SO3溶液,测溶液的pH | pH约为9 |
| ii | 配制0.05 mol·L−1的K2Cr2O7溶液,把溶液平均分成两份,向两份溶液中分别滴加浓硫酸和浓KOH溶液,得到pH=2的溶液A和pH=8的溶液B | pH=2的溶液A呈橙色;pH=8的溶液B呈黄色 |
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:
(2)进行实验iii和iv:
| 序号 | 操作 | 现象 |
| iii | 向2 mL溶液A中滴加3滴饱和Na2SO3溶液 | 溶液变绿色(含Cr3+) |
| iv | 向2 mL溶液B中滴加3滴饱和Na2SO3溶液 | 溶液没有明显变化 |
②用离子方程式解释iii中现象:
(3)继续进行实验v:
| 序号 | 操作 | 现象 |
| v | 向2 mL饱和Na2SO3溶液中滴加3滴溶液A | 溶液变黄色 |
| vi | 向2 mL蒸馏水中滴加3滴溶液A | 溶液变浅橙色 |
③实验vi的目的是
④用化学平衡移动原理解释v中现象:
⑤根据实验iii~v,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,
⑥向实验v所得黄色溶液中滴加
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,电压为a。
b.向U形管左侧溶液中滴加3滴浓硫酸后,电压增大了b。
⑦上述实验说明:
⑧有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论。该实验方案是
您最近一年使用:0次
4 . 某小组同学探究Cu和H2O2的反应。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
(2)实验ⅱ中:溶液变蓝的原因是________ (用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________ 。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
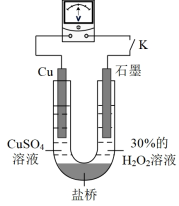
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________ 。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______ 。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________ 。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________ 。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
| 装置 | 序号 | 试剂a | 现象 |
 | ⅱ | 20 mL 30% H2O2与4 mL 5 mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:
(6)基于以上实验,影响Cu与H2O2反应速率的因素有
您最近一年使用:0次
2020-06-06更新
|
339次组卷
|
3卷引用:北京市丰台区2020届高三下学期高三综合练习(二)化学试题
解题方法
5 . 某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制0.5 mol·L-1 FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用_____________________________ 。
该实验小组做如下实验。
(2)进一步研究证实,黑色沉淀的主要成分是FeS。Na2S 溶液呈碱性,FeSO4溶液与其反应不生成Fe(OH) 2而生成FeS的可能原因是_____________________ 。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:___________ 、_____________ 。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a. Fe3+ 被H2O2还原 b. SCN- 被O2氧化 c. SCN-被H2O2氧化
乙同学根据上述实验现象认为假设b不成立,他依据的现象是________________ 。
甲同学利用上述部分试剂,通过以下实验验证了假设c成立。请将以下实验操作及现象补充完整。
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

① C、D中的溶液依次是__________ 、________ (填字母标号)。
a.品红溶液 b.NaOH溶液 c.BaCl2 溶液
d.Ba(NO3)2 溶液 e.浓H2SO4
② C、D中有气泡冒出,并可观察到的现象分别是____________ 、______________ 。
③ 写出硫酸亚铁高温分解反应的化学方程式______________________________ 。
(1)配制0.5 mol·L-1 FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用
该实验小组做如下实验。
| 实验序号 | 操作及现象 |
| ⅰ | 取2 mL上述FeSO4溶液于试管中,逐滴加入少量0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
| ⅱ | 取2 mL上述FeSO4溶液于试管中,加入2滴1 mol·L-1 KSCN溶液无现象,通入一段时间O2,溶液变为浅红色 |
| ⅲ | 重复实验ⅱ,向浅红色溶液中加入5% H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是FeS。Na2S 溶液呈碱性,FeSO4溶液与其反应不生成Fe(OH) 2而生成FeS的可能原因是
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a. Fe3+ 被H2O2还原 b. SCN- 被O2氧化 c. SCN-被H2O2氧化
乙同学根据上述实验现象认为假设b不成立,他依据的现象是
甲同学利用上述部分试剂,通过以下实验验证了假设c成立。请将以下实验操作及现象补充完整。
| 步骤 | 试剂及操作 | 现 象 |
| i | 取褪色后溶液一份滴加FeCl3溶液 | ① |
| ii | ② | ③ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

① C、D中的溶液依次是
a.品红溶液 b.NaOH溶液 c.BaCl2 溶液
d.Ba(NO3)2 溶液 e.浓H2SO4
② C、D中有气泡冒出,并可观察到的现象分别是
③ 写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次



