1 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)过氧化钠可用作潜水艇和消防员呼吸面具中的供氧剂,其主要原理为: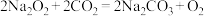 。其中Na2O2的阴、阳离子个数比为
。其中Na2O2的阴、阳离子个数比为________ 。每消耗2个CO2分子,转移电子的数目为________ 个。在下列选项中选择,上述反应中Na2O2是________ (填字母,下同),O2是________ .
A.氧化剂 B.还原剂 C.氧化产物 D.还原产物
若要反应产生64.0gO2,同时消耗Na2O2的质量约为________ g。
(2)汽车尾气系统中均安装了催化转化器。汽车尾气中有毒的CO和NO在催化剂高温条件下发生反应,生成两种无毒气体。上述反应的化学方程式为: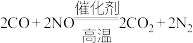 用单线桥标出反应中电子转移的方向和数目
用单线桥标出反应中电子转移的方向和数目________ 。
该反应中,氧化产物与还原产物的分子数之比为________ 。
(3)亚硝酸钠NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+,可服用维生素C解毒。关于该过程的叙述,不正确的是________(填字母)。
(1)过氧化钠可用作潜水艇和消防员呼吸面具中的供氧剂,其主要原理为:
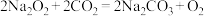 。其中Na2O2的阴、阳离子个数比为
。其中Na2O2的阴、阳离子个数比为A.氧化剂 B.还原剂 C.氧化产物 D.还原产物
若要反应产生64.0gO2,同时消耗Na2O2的质量约为
(2)汽车尾气系统中均安装了催化转化器。汽车尾气中有毒的CO和NO在催化剂高温条件下发生反应,生成两种无毒气体。上述反应的化学方程式为:
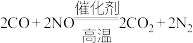 用单线桥标出反应中电子转移的方向和数目
用单线桥标出反应中电子转移的方向和数目该反应中,氧化产物与还原产物的分子数之比为
(3)亚硝酸钠NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+,可服用维生素C解毒。关于该过程的叙述,不正确的是________(填字母)。
| A.亚硝酸钠的氧化性强于Fe3+ | B.维生素C是还原剂 |
| C.维生素C的还原性强于Fe2+ | D.亚硝酸钠是还原剂 |
您最近一年使用:0次
名校
解题方法
2 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠 较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________(填标号)。
较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________(填标号)。
(2)我国从2000年起逐步用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,
,________ 是还原剂,________ 是还原产物,用单线桥法表示反应中电子得失的方向和数目:___________ 。
(3)某温度下将 通入
通入 溶液里,反应后得到
溶液里,反应后得到 、
、 、
、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为
的个数之比为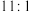 ,则
,则 与
与 反应时,被还原的氯原子和被氧化的氯原子的个数之比为
反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(1)亚氯酸钠
 较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________(填标号)。
较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________(填标号)。A. 、 、 | B. 、 、 |
C. 、 、 | D. 、 、 |
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,
,(3)某温度下将
 通入
通入 溶液里,反应后得到
溶液里,反应后得到 、
、 、
、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为
的个数之比为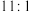 ,则
,则 与
与 反应时,被还原的氯原子和被氧化的氯原子的个数之比为
反应时,被还原的氯原子和被氧化的氯原子的个数之比为
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)中国古代著作中有“银针验毒”的记录,其原理为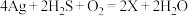 ,则X的化学式是
,则X的化学式是___________ ,其中 在该反应中
在该反应中___________ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)按如图所示操作,充分反应后:
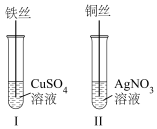
①II中铜丝上观察到的现象是___________ 。
②结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________ 。
(3)阅读下面一段材料并回答问题。
高铁酸钾使用说明书
【化学式】K2FeO4
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
①K2FeO4中铁元素的化合价为___________ 。
下列关于K2FeO4的说法中,不正确的是___________ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
②制备高铁酸钾时,先制备得到Na2FeO4,反应为 ,该反应的氧化产物是
,该反应的氧化产物是________ ;每生成1molNa2FeO4转移___________ mol电子。
(1)中国古代著作中有“银针验毒”的记录,其原理为
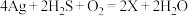 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)按如图所示操作,充分反应后:

①II中铜丝上观察到的现象是
②结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为
(3)阅读下面一段材料并回答问题。
高铁酸钾使用说明书
【化学式】K2FeO4
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
①K2FeO4中铁元素的化合价为
下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
②制备高铁酸钾时,先制备得到Na2FeO4,反应为
 ,该反应的氧化产物是
,该反应的氧化产物是
您最近一年使用:0次
名校
4 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
(2)我国用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:___________ 。将该反应化学方程式改写为离子方程式:___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下降 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(5)实验室用下列方法均可制取氯气
① ③
③
②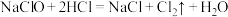 ②
②
③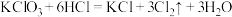 ④
④
若各反应转移的电子数相同,①②③生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下降
 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为(5)实验室用下列方法均可制取氯气
①
 ③
③②
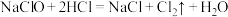 ②
②③
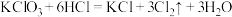 ④
④若各反应转移的电子数相同,①②③生成的氯气质量比为
您最近一年使用:0次
名校
解题方法
5 . 氧化还原反应原理在生产、生活中应用广泛。
(1)下列反应中不涉及氧化还原反应的是___________ 。
a.蜡炬成灰 b.水滴石穿 c.食物腐败
(2)已知实验室制取NO的反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,反应的离子方程式是___________ ,硝酸在反应中体现___________________ 。
a.还原性 b.还原性和酸性 c.氧化性 d.氧化性和酸性
(3)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO3+HNO2,在3个反应中一定不可能实现的是___________ 。
(4)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为 ,此反应的离子方程式为
,此反应的离子方程式为___________ 。
(5)亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。 误食NaNO2会导致人体血红蛋白中的Fe2+转化为Fe3+而中毒,该过程中NaNO2表现出的性质与下列___________(填序号)反应中H2O2表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
(1)下列反应中不涉及氧化还原反应的是
a.蜡炬成灰 b.水滴石穿 c.食物腐败
(2)已知实验室制取NO的反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,反应的离子方程式是
a.还原性 b.还原性和酸性 c.氧化性 d.氧化性和酸性
(3)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO3+HNO2,在3个反应中一定不可能实现的是
(4)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为
 ,此反应的离子方程式为
,此反应的离子方程式为(5)亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。 误食NaNO2会导致人体血红蛋白中的Fe2+转化为Fe3+而中毒,该过程中NaNO2表现出的性质与下列___________(填序号)反应中H2O2表现出的性质相同。
A. |
B.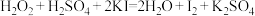 |
C. |
D. |
您最近一年使用:0次
名校
解题方法
6 . 钒性能优良,用途广泛,有“金属维生素”之称。完成下列填空:
(1)废钒催化剂(主要成分为 )通常要采用稀硫酸来进行溶解,若实验室需要配制2.0mol/L的稀硫酸500mL,则
)通常要采用稀硫酸来进行溶解,若实验室需要配制2.0mol/L的稀硫酸500mL,则
①所需质量分数为98%,密度为1.84g/cm 的浓硫酸
的浓硫酸_____ mL。
②浓硫酸用于配制稀硫酸时,需先进行稀释,稀释浓硫酸的方法是_____ 。
③在配制上述溶液的实验中,下列操作引起结果偏低的有_____ (填标号)。
A.该学生在量取浓硫酸时,俯视刻度线
B.没有用蒸馏水洗涤烧杯2~3次
C.稀释浓硫酸后没有冷却至室温就立即完成后面的配制操作
D.在烧杯中稀释搅拌时,溅出少量溶液
(2)将废钒催化剂(主要成分为 )与稀硫酸、亚硫酸钾溶液混合,充分反应后生成
)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成 等离子,该反应的化学方程式是
等离子,该反应的化学方程式是_____ 。
(3)向上述所得溶液中加入 溶液,完善并配平反应的离子方程式:
溶液,完善并配平反应的离子方程式:_____ 。
□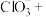 □
□ □_____
□_____ □
□ □
□ □_____
□_____
(4) 能与盐酸反应产生
能与盐酸反应产生 和一种黄绿色气体,该气体能与
和一种黄绿色气体,该气体能与 溶液反应从而被吸收,则
溶液反应从而被吸收,则 、
、 、
、 还原性由大到小的顺序是
还原性由大到小的顺序是_____ 。
(5)在20.00mL mol/L的溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
mol/L的溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是_____ (填标号)。
A. B.
B. C.V
C.V
(1)废钒催化剂(主要成分为
 )通常要采用稀硫酸来进行溶解,若实验室需要配制2.0mol/L的稀硫酸500mL,则
)通常要采用稀硫酸来进行溶解,若实验室需要配制2.0mol/L的稀硫酸500mL,则①所需质量分数为98%,密度为1.84g/cm
 的浓硫酸
的浓硫酸②浓硫酸用于配制稀硫酸时,需先进行稀释,稀释浓硫酸的方法是
③在配制上述溶液的实验中,下列操作引起结果偏低的有
A.该学生在量取浓硫酸时,俯视刻度线
B.没有用蒸馏水洗涤烧杯2~3次
C.稀释浓硫酸后没有冷却至室温就立即完成后面的配制操作
D.在烧杯中稀释搅拌时,溅出少量溶液
(2)将废钒催化剂(主要成分为
 )与稀硫酸、亚硫酸钾溶液混合,充分反应后生成
)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成 等离子,该反应的化学方程式是
等离子,该反应的化学方程式是(3)向上述所得溶液中加入
 溶液,完善并配平反应的离子方程式:
溶液,完善并配平反应的离子方程式:□
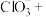 □
□ □_____
□_____ □
□ □
□ □_____
□_____(4)
 能与盐酸反应产生
能与盐酸反应产生 和一种黄绿色气体,该气体能与
和一种黄绿色气体,该气体能与 溶液反应从而被吸收,则
溶液反应从而被吸收,则 、
、 、
、 还原性由大到小的顺序是
还原性由大到小的顺序是(5)在20.00mL
 mol/L的溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
mol/L的溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是A.
 B.
B. C.V
C.V
您最近一年使用:0次
2023-12-24更新
|
145次组卷
|
3卷引用:湖南省长郡中学2023-2024学年高一上学期选科适应性调研检测化学试题
名校
7 . 钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
①KClO4是助氧化剂,可处理产生的Na,其中氯元素的化合价是_______ 。
②Fe2O3是主氧化剂,也可处理产生的Na,反应为6Na+Fe2O3=3Na2O+2Fe。反应中Na2O是_______ (填“还原产物”或“氧化产物”)。
(2)电子工业常用30%的FeCl₃溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①FeCl3溶液与金属铜反应生成FeCl2和CuCl2的离子方程式为_______ 。
②将FeCl3饱和溶液滴入沸水中,并继续加热至液体呈红褐色停止加热,制得分散系为_______ (填“溶液”“胶体”或“浊液”)。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
①KClO4是助氧化剂,可处理产生的Na,其中氯元素的化合价是
②Fe2O3是主氧化剂,也可处理产生的Na,反应为6Na+Fe2O3=3Na2O+2Fe。反应中Na2O是
(2)电子工业常用30%的FeCl₃溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①FeCl3溶液与金属铜反应生成FeCl2和CuCl2的离子方程式为
②将FeCl3饱和溶液滴入沸水中,并继续加热至液体呈红褐色停止加热,制得分散系为
您最近一年使用:0次
名校
解题方法
8 . 氧化还原反应在生产、生活中具有广泛的用途。下列生产生活中的事例不属于氧化还原反应的是
| A.金属冶炼 | B.燃放鞭炮 | C.食物腐败 | D.用醋酸去除水垢 |
您最近一年使用:0次
2021-10-16更新
|
124次组卷
|
3卷引用:湖南省长沙市明德中学2022-2023学年高一上学期10月阶段考试化学试题



