名校
1 . 氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br-,可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO 与ClO
与ClO ,在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。下列关于氯及其化合物的性质与用途具有对应关系的是
,在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。下列关于氯及其化合物的性质与用途具有对应关系的是
 与ClO
与ClO ,在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。下列关于氯及其化合物的性质与用途具有对应关系的是
,在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。下列关于氯及其化合物的性质与用途具有对应关系的是| A.NaClO3具有氧化性,可用于制取ClO2 |
| B.Cl2有还原性,可用于从海水中提取溴 |
| C.HClO不稳定,可用于棉、麻漂白 |
| D.FeCl3溶液呈酸性,可用于蚀刻印刷电路板 |
您最近一年使用:0次
2023-04-27更新
|
602次组卷
|
2卷引用:广东省阳江市2023-2024学年高二上学期10月月考化学试题
2021高一·全国·专题练习
2 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
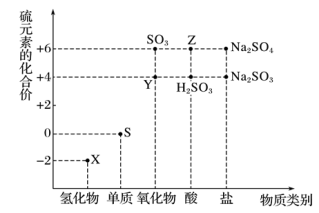
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为___________ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
您最近一年使用:0次
名校
解题方法
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______ (填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________ 。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl−和NO3-,其离子方程式为______________________________________ 。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________ 。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________ 。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________ 。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为
(4)W的稀溶液与铜单质发生反应的离子方程式为
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为
您最近一年使用:0次
2020-01-09更新
|
479次组卷
|
6卷引用:广东省梅州兴宁市沐彬中学2021-2022学年高一下学期 3月月考化学试题
4 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠 较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为__________(填标号)。
较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为__________(填标号)。
(2)我国从2000年起逐步用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,
,__________ 是还原剂,__________ 是还原产物,用单线桥法表示反应中电子得失的方向和数目:__________ 。
(3)工业上可利用 制备亚氯酸钠
制备亚氯酸钠 ,反应体系中涉及下列物质:
,反应体系中涉及下列物质: 、
、 、
、 、
、 、
、 、
、 写出反应的化学方程式:
写出反应的化学方程式:__________ 。
(4)某温度下将 通入
通入 溶液里,反应后得到
溶液里,反应后得到 、
、 、
、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为
的个数之比为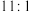 ,则
,则 与
与 反应时,被还原的氯原子和被氧化的氯原子的个数之比为
反应时,被还原的氯原子和被氧化的氯原子的个数之比为__________ 。
(5)已知氧化性: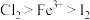 ,写出少量氯气通入到碘化亚铁溶液中的离子方程式:
,写出少量氯气通入到碘化亚铁溶液中的离子方程式:__________ 。
(1)亚氯酸钠
 较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为__________(填标号)。
较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为__________(填标号)。A. 、 、 | B. 、 、 |
C. 、 、 | D. 、 、 |
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,
,(3)工业上可利用
 制备亚氯酸钠
制备亚氯酸钠 ,反应体系中涉及下列物质:
,反应体系中涉及下列物质: 、
、 、
、 、
、 、
、 、
、 写出反应的化学方程式:
写出反应的化学方程式:(4)某温度下将
 通入
通入 溶液里,反应后得到
溶液里,反应后得到 、
、 、
、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为
的个数之比为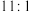 ,则
,则 与
与 反应时,被还原的氯原子和被氧化的氯原子的个数之比为
反应时,被还原的氯原子和被氧化的氯原子的个数之比为(5)已知氧化性:
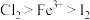 ,写出少量氯气通入到碘化亚铁溶液中的离子方程式:
,写出少量氯气通入到碘化亚铁溶液中的离子方程式:
您最近一年使用:0次
5 . 某废合金的主要成分为Sn、Cu、Pb、Fe,一种综合回收的工艺流程如图所示:

已知:常温下,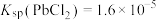 ,
, ,
, 。
。
回答下列问题:
(1)“氯化浸出”浸出液中金属阳离子主要有 、
、 、
、_______ ;浸渣的主要成分为_______ (填化学式)。“氯化没出”时温度不宜过高或过低的原因是_______ 。
(2)写出“还原”中Fe与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)常温下,为使 完全沉淀,“调pH”时应使溶液pH不低于
完全沉淀,“调pH”时应使溶液pH不低于_______ (结果保留1位小数)。
(4)“氧化”时为检验 是否已被充分氧化,可取样滴加
是否已被充分氧化,可取样滴加_______ (填化学式)溶液。
(5)写出“沉铁”时发生反应的离子反应方程式:_______ 。
(6) 受热后可制得物质A,写出物质A的一种用途:
受热后可制得物质A,写出物质A的一种用途:_______ 。

已知:常温下,
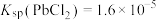 ,
, ,
, 。
。回答下列问题:
(1)“氯化浸出”浸出液中金属阳离子主要有
 、
、 、
、(2)写出“还原”中Fe与
 反应的化学方程式:
反应的化学方程式:(3)常温下,为使
 完全沉淀,“调pH”时应使溶液pH不低于
完全沉淀,“调pH”时应使溶液pH不低于(4)“氧化”时为检验
 是否已被充分氧化,可取样滴加
是否已被充分氧化,可取样滴加(5)写出“沉铁”时发生反应的离子反应方程式:
(6)
 受热后可制得物质A,写出物质A的一种用途:
受热后可制得物质A,写出物质A的一种用途:
您最近一年使用:0次
2023-02-27更新
|
604次组卷
|
2卷引用:广东省广州市等3地东莞市东华松山湖高级中学有限公司等2校2023届高三下学期一模化学试题
6 . 锰及其化合物用途广泛,以菱锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐以及SiO2杂质)为原料生产金属锰和高品位MnCO3的工艺流程如图。

已知25℃,部分物质的溶度积常数如表:
(1)“溶浸”时,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件(温度、时间)为______ 。

(2)MnO2主要用于氧化______ 。滤渣1中残余的MnO2可加入葡萄糖一硫酸溶液处理,回收Mn2+,氧化产物为CO2。写出对应的离子方程式______ 。
(3)“除杂”步骤所得滤渣2的主要成分为MnS、______ (填化学式,其中Co、Ni均为+2价)。
(4)“沉锰”时NH4HCO3除了作沉淀剂外,还有______ 作用;“沉锰”的关键操作有两点:①将NH4HCO3溶液加入MnSO4溶液中;②反应终点pH在7附近。如果①中颠倒试剂滴加顺序(反应pH大于7),可能造成的后果是______ ;若反应终点pH低于7,可能的后果是______ 。
(5)以Fe作电极,MnSO4、ZnSO4溶液为电解液,经过一系列步骤制得隐形战机涂料Zn2Mn(1-x)Fe2O4,则电解时阳极生成Zn2Mn(1-x)Fe2O4的总反应为_______ 。

已知25℃,部分物质的溶度积常数如表:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 |

(2)MnO2主要用于氧化
(3)“除杂”步骤所得滤渣2的主要成分为MnS、
(4)“沉锰”时NH4HCO3除了作沉淀剂外,还有
(5)以Fe作电极,MnSO4、ZnSO4溶液为电解液,经过一系列步骤制得隐形战机涂料Zn2Mn(1-x)Fe2O4,则电解时阳极生成Zn2Mn(1-x)Fe2O4的总反应为
您最近一年使用:0次
2022-03-23更新
|
893次组卷
|
3卷引用:必刷卷01-2022年高考化学考前信息必刷卷(广东专用)
名校
7 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,以下是氯元素的“价类二维图”的部分信息。请回答下列问题:

(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)已知高氯酸( )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式_______ 。
(3)氯气既有氧化性又有还原性,结合上图说明理由_______ 
(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式_______ ,该反应中盐酸表现_______ (填字母)。
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为 ,下列有关该反应说法
,下列有关该反应说法不正确 的是_______。
(6)某游泳池常用 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式_______ 。

(1)根据图中信息写出Y、Z的化学式
(2)已知高氯酸(
 )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式(3)氯气既有氧化性又有还原性,结合上图说明理由

(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为
 ,下列有关该反应说法
,下列有关该反应说法| A.n(氧化剂):n(还原剂)=1:1 | B.n(氧化剂):n(还原剂)=1:2 |
C.氧化性: | D. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式
您最近一年使用:0次
2022-03-20更新
|
1086次组卷
|
3卷引用:广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题
广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题河北省三河市第二中学2021-2022学年高一上学期期末考试化学试题(已下线)第二章《 海水中的重要元素----钠和氯》基础过关单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
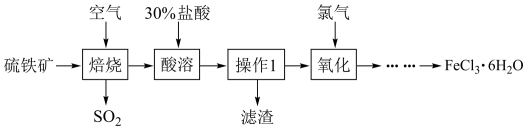
8 . 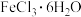 在工业上有广泛的用途。以下是以硫铁矿(主要成分为
在工业上有广泛的用途。以下是以硫铁矿(主要成分为 )为原料制备
)为原料制备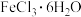 的工艺流程。下列说法正确的是
的工艺流程。下列说法正确的是
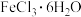 在工业上有广泛的用途。以下是以硫铁矿(主要成分为
在工业上有广泛的用途。以下是以硫铁矿(主要成分为 )为原料制备
)为原料制备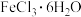 的工艺流程。下列说法正确的是
的工艺流程。下列说法正确的是
A.在焙烧过程中,每生成  转移 转移 电子 电子 |
| B.过滤时需要用到的玻璃仪器为分液漏斗、玻璃棒和烧杯 |
C.氧化过程的离子方程式为 |
| D.……表示的操作为在氯化氢气流中蒸发浓缩、冷却结晶、过滤 |
您最近一年使用:0次
名校
解题方法
9 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是___________ ,具有___________ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作___________ (填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:___________ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为___________ 。
②装置C中观察到的现象是___________ ,反应的化学方程式是___________ 。
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是___________ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作
反应过程中氧化产物与还原产物的个数比为:
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为
②装置C中观察到的现象是
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是
您最近一年使用:0次
2021-03-21更新
|
588次组卷
|
4卷引用:广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题
广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题重庆市南坪中学2020-2021学年高一上学期期中考试化学试题黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
10 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是________ (填写字母代号)。
A.铝的表面生成致密的薄膜 B.大理石雕像被酸雨腐蚀毁坏
C.食物腐败 D.燃放烟花
(2)过氧化氢水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl==2NaCl+H2O2 B.Ag2O+H2O2==2Ag+O2↑+H2O
C.2H2O2==2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH==2K2CrO4+3K2SO4+8H2O
①上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)________ ,H2O2既体现氧化性又体现还原性的反应是________ 。
②H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为________ 。
(3)氯化铵常用于焊接金属。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为____ CuO+____ NH4Cl
____ Cu+____ CuCl2+____ N2↑+____ H2O。
①配平此氧化还原反应方程式。
②反应中若产生0.2 mol的气体,则有________ mol的电子转移。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
A.铝的表面生成致密的薄膜 B.大理石雕像被酸雨腐蚀毁坏
C.食物腐败 D.燃放烟花
(2)过氧化氢水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl==2NaCl+H2O2 B.Ag2O+H2O2==2Ag+O2↑+H2O
C.2H2O2==2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH==2K2CrO4+3K2SO4+8H2O
①上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)
②H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为
(3)氯化铵常用于焊接金属。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为

①配平此氧化还原反应方程式。
②反应中若产生0.2 mol的气体,则有
您最近一年使用:0次



