2022高三·全国·专题练习
1 . 黄钠铁矾[NaFe3 (SO4)2(OH)6]是一种高效净水剂,Ni(OH)2可作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备黄钠铁矾和Ni (OH)2,工艺流程如图所示。
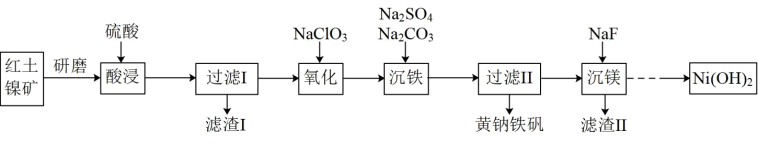
已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
“氧化”过程中发生反应的离子方程式为:_______ ;为 了证明加入的NaClO3已足量,可取“氧化”后的溶液,向其中加入_______ 来检验(填标号)。
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 c.酸性KMnO4溶液

已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
“氧化”过程中发生反应的离子方程式为:
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 c.酸性KMnO4溶液
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
2 . 铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳酸铈(主要含CeFCO3)为原料制备CeO2的工艺流程如下:

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为_______ 。
(2)“反萃取”步骤中发生反应的离子方程式为_______ 。

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为
(2)“反萃取”步骤中发生反应的离子方程式为
您最近一年使用:0次
2022·广东潮州·二模
名校
解题方法
3 . 亚氯酸钠( )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白。过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白。过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示:

已知:
① 的熔点为-59℃、沸点为11℃,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生分解,若用空气、
的熔点为-59℃、沸点为11℃,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生分解,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。
②
回答下列问题:
(1)按上图组装好仪器后,首先应该进行的操作是_______ ;装置B的作用是_______ ;冰水浴冷却的主要目的不包括_______ (填字母)。
a.减少 的分解 b.降低
的分解 b.降低 的溶解度 c.减少
的溶解度 c.减少 的分解
的分解
(2) 是合成
是合成 的重要原料,写出三颈烧瓶中生成
的重要原料,写出三颈烧瓶中生成 的化学方程式:
的化学方程式:_______ 。
(3)装置C中加入NaOH溶液的目的除了作反应物外,还因为_______ 。空气的流速过慢时, 不能及时被移走,浓度过高导致分解可能发生爆炸;空气流速过快时,则导致
不能及时被移走,浓度过高导致分解可能发生爆炸;空气流速过快时,则导致_______ 。
(4)该套装置存在的明显缺陷是_______ 。
(5)为防止生成的 固体被继续还原为NaCl,所用还原剂的还原性应适中。除
固体被继续还原为NaCl,所用还原剂的还原性应适中。除 外,还可以选择的还原剂是_______(填字母)
外,还可以选择的还原剂是_______(填字母)
(6)若mg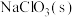 最终制得纯净的ng
最终制得纯净的ng ,则
,则 的产率是
的产率是_______ ×100%。(相对分子质量分别是 :106.5
:106.5  :90.5)
:90.5)
 )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白。过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白。过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示:
已知:
①
 的熔点为-59℃、沸点为11℃,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生分解,若用空气、
的熔点为-59℃、沸点为11℃,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生分解,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。②

回答下列问题:
(1)按上图组装好仪器后,首先应该进行的操作是
a.减少
 的分解 b.降低
的分解 b.降低 的溶解度 c.减少
的溶解度 c.减少 的分解
的分解(2)
 是合成
是合成 的重要原料,写出三颈烧瓶中生成
的重要原料,写出三颈烧瓶中生成 的化学方程式:
的化学方程式:(3)装置C中加入NaOH溶液的目的除了作反应物外,还因为
 不能及时被移走,浓度过高导致分解可能发生爆炸;空气流速过快时,则导致
不能及时被移走,浓度过高导致分解可能发生爆炸;空气流速过快时,则导致(4)该套装置存在的明显缺陷是
(5)为防止生成的
 固体被继续还原为NaCl,所用还原剂的还原性应适中。除
固体被继续还原为NaCl,所用还原剂的还原性应适中。除 外,还可以选择的还原剂是_______(填字母)
外,还可以选择的还原剂是_______(填字母)| A.过氧化钠 | B.硫化钠 | C.氯化亚铁 | D.高锰酸钾 |
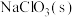 最终制得纯净的ng
最终制得纯净的ng ,则
,则 的产率是
的产率是 :106.5
:106.5  :90.5)
:90.5)
您最近一年使用:0次
2022-05-21更新
|
660次组卷
|
5卷引用:专题16 化学实验综合题-2022年高考真题模拟题分项汇编
(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)广东省潮州市2022届高三下学期第二次模拟考试化学试题上海市七宝中学2023-2024学年高一上学期化学12月练习卷



