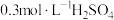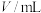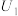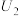23-24高一上·湖北荆州·期中
名校
解题方法
1 . 某同学欲探究H2O2的氧化还原性:
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,探究H2O2的氧化性可以选取的物质是:___________ (填序号)
①淀粉KI溶液(酸性) ②酸性KMnO4溶液 ③Cl2 ④HNO3溶液
任选一个你所选的物质进行实验,观察到___________ 现象,证明H2O2有氧化性,反应的离子方程式为___________ 。
(2)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
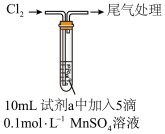
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有___________ 性,能与H2O2反应产生MnO2
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,探究H2O2的氧化性可以选取的物质是:
①淀粉KI溶液(酸性) ②酸性KMnO4溶液 ③Cl2 ④HNO3溶液
任选一个你所选的物质进行实验,观察到
(2)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i | 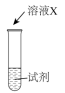 | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii | H2O2溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
您最近一年使用:0次
2022·北京西城·二模
名校
解题方法
2 . 在处理NO废气的过程中,催化剂[Co(NH3)6]2+会逐渐失活变为[Co(NH3)6]3+。某小组为解决这一问题,实验研究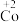 和
和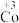 之间的相互转化。
之间的相互转化。
资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105
Co3++6NH3 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035
iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH
(1)探究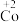 的还原性
的还原性
实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。
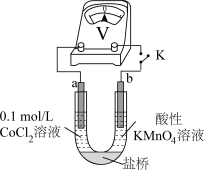
①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,____ (补全实验操作及现象),否定了该观点。
②探究碱性条件下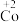 的还原性,进行实验。
的还原性,进行实验。
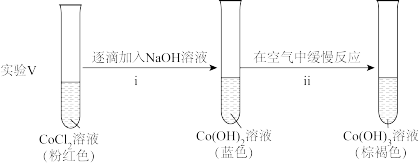
ii中反应的化学方程式是____ 。
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但____ 降低的程度更大,还原剂的还原性增强。
(2)探究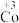 的氧化性
的氧化性
①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,____ (补全实验操作及现象),反应的离子方程式是____ 。
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是____ 。
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:____ 。
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:____ 。
示例:Co CoCl2
CoCl2 Co(OH)2
Co(OH)2
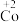 和
和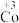 之间的相互转化。
之间的相互转化。资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3
 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105Co3++6NH3
 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH

(1)探究
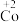 的还原性
的还原性实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,
②探究碱性条件下
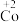 的还原性,进行实验。
的还原性,进行实验。
ii中反应的化学方程式是
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但
(2)探究
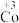 的氧化性
的氧化性①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:
示例:Co
 CoCl2
CoCl2 Co(OH)2
Co(OH)2
您最近一年使用:0次
2022-05-08更新
|
1327次组卷
|
9卷引用:北京市海淀区2022届高三一模(实验探究题)
2023·广东深圳·一模
名校
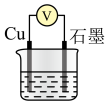
3 . 某学习小组将Cu与 的反应设计为原电池,并进行相关实验探究。回答下列问题:
的反应设计为原电池,并进行相关实验探究。回答下列问题:
I.实验准备
(1)稀硫酸的配制
①配制 的
的 溶液,需
溶液,需 溶液的体积为
溶液的体积为______ mL。
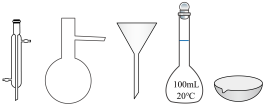
②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是__________ (填仪器名称)。
(2)Cu与 在酸性条件下反应的离子方程式为
在酸性条件下反应的离子方程式为__________ 。
II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(3)利用下表所示装置进行实验1~4,记录数据。
已知:本实验条件下, 对电压的影响可忽略。
对电压的影响可忽略。
①根据表中信息,补充数据:
__________ 。
②由实验2和4可知,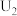
______ 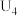 (填“大于”或“小于”或“等于”),说明其他条件相同时,
(填“大于”或“小于”或“等于”),说明其他条件相同时, 溶液的浓度越大,其氧化性越强。
溶液的浓度越大,其氧化性越强。
(4)由(3)中实验结果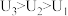 ,小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
,小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下, 的氧化性随pH减小而增强。
的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~-7,并记录数据。
②实验结果为: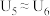 、
、______ ,说明猜想2不成立,猜想1成立。
(5)已知Cu与 反应时,加入氨水可形成深蓝色的
反应时,加入氨水可形成深蓝色的 。小组同学利用(4)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:
。小组同学利用(4)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:__________ 。
【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
 的反应设计为原电池,并进行相关实验探究。回答下列问题:
的反应设计为原电池,并进行相关实验探究。回答下列问题:I.实验准备
(1)稀硫酸的配制
①配制
 的
的 溶液,需
溶液,需 溶液的体积为
溶液的体积为②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是

(2)Cu与
 在酸性条件下反应的离子方程式为
在酸性条件下反应的离子方程式为II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(3)利用下表所示装置进行实验1~4,记录数据。
装置 | 实验 序号 | 烧杯中所加试剂 | 电压表 读数 | ||
| 30% |
|
| ||
|
|
| |||
1 | 30.0 | / | 10.0 |
| |
2 | 30.0 | 1.0 | 9.0 |
| |
3 | 30.0 | 2.0 | 8.0 |
| |
4 | 35.0 | 1.0 |
|
| |
 对电压的影响可忽略。
对电压的影响可忽略。①根据表中信息,补充数据:

②由实验2和4可知,
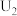
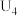 (填“大于”或“小于”或“等于”),说明其他条件相同时,
(填“大于”或“小于”或“等于”),说明其他条件相同时, 溶液的浓度越大,其氧化性越强。
溶液的浓度越大,其氧化性越强。(4)由(3)中实验结果
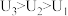 ,小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
,小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:猜想1:酸性条件下,
 的氧化性随pH减小而增强。
的氧化性随pH减小而增强。猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~-7,并记录数据。
装置 | 实验 序号 | 操作 | 电压表 读数 |
| 5 | / |
|
6 | ①向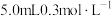  溶液。 溶液。 |
| |
7 | 向另一侧烧杯中滴加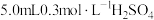 溶液 溶液 |
|
 、
、(5)已知Cu与
 反应时,加入氨水可形成深蓝色的
反应时,加入氨水可形成深蓝色的 。小组同学利用(4)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:
。小组同学利用(4)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
您最近一年使用:0次
2023-02-19更新
|
1785次组卷
|
4卷引用:广东省深圳市2022-2023学年高三第一次调研考试变式题(实验综合题)
(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(实验综合题)(已下线)专题19 实验综合题广东省深圳市2022-2023学年高三第一次调研考试化学试题福建省泉州市泉港区第一中学、厦门外国语学校石狮分校2023-2024学年高二上学期期中考试化学试题
2022·北京朝阳·三模
名校
解题方法
4 . 某小组探究 和
和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
【实验探究】
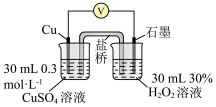
实验i:向装有0.5g 的烧杯中加入20mL30%
的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊, 片表面附着少量蓝色固体。
片表面附着少量蓝色固体。
(1)写出该反应的化学方程式:_______ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是_______ (用离子反应方程式表示);经检验产生的气体为氧气,产生氧气的原因是_______ 。
(3)对比实验i和iii,为探究氨水对 的还原性或
的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
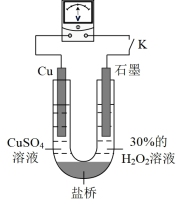
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①利用电极反应解释该实验的结论:_______ 。
②利用该方法也可证明酸性增强可提高 的氧化性,与上述实验操作不同的是
的氧化性,与上述实验操作不同的是_______ 。
(4)总结:物质氧化性和还原性变化的一般规律是_______ 。
(5)应用: 分别与
分别与 的盐酸、氢溴酸、氢碘酸混合,
的盐酸、氢溴酸、氢碘酸混合, 只与氢碘酸发生置换反应,试解释原因
只与氢碘酸发生置换反应,试解释原因_______ 。
 和
和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。【实验探究】
实验i:向装有0.5g
 的烧杯中加入20mL30%
的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊, 片表面附着少量蓝色固体。
片表面附着少量蓝色固体。(1)写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
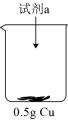 | ii | 20mL30% 与4mL 与4mL5mol/L  混合液 混合液 |  表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| iii | 20mL30% 与4mL 与4mL5mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡, 表面有少量蓝色不溶物 表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究氨水对
 的还原性或
的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①利用电极反应解释该实验的结论:
②利用该方法也可证明酸性增强可提高
 的氧化性,与上述实验操作不同的是
的氧化性,与上述实验操作不同的是(4)总结:物质氧化性和还原性变化的一般规律是
(5)应用:
 分别与
分别与 的盐酸、氢溴酸、氢碘酸混合,
的盐酸、氢溴酸、氢碘酸混合, 只与氢碘酸发生置换反应,试解释原因
只与氢碘酸发生置换反应,试解释原因
您最近一年使用:0次
2022-06-03更新
|
535次组卷
|
4卷引用:易错点21 化学反应速率-备战2023年高考化学考试易错题
(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)微专题 物质性质综合实验探究北京市和平街第一中学2021-2022学年高三下学期保温化学试题北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题
名校
5 . 某小组探究 氧化性、还原性的变化规律。
氧化性、还原性的变化规律。
资料: 、
、
(1)制备 :将
:将 溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀 ,得溶液B。溶
,得溶液B。溶 用冰水,目的是
用冰水,目的是_______ 。
(2)检验 :向溶液A、B中分别滴加适量酸性
:向溶液A、B中分别滴加适量酸性 溶液。
溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
 发生还原反应:
发生还原反应:
 发生氧化反应:
发生氧化反应:_______ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:
猜想1. 有氧化性,能被还原为
有氧化性,能被还原为
猜想2. 有
有_______ 性,能与 反应产生
反应产生
猜想3.……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
ⅲ是ⅱ和ⅰ的对照实验。
①X是_______ 。
②a是_______ 、b是_______ 。
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。
(4)向一定浓度的 溶液中加入少量
溶液中加入少量 ,迅速产生大量气泡;随后加入
,迅速产生大量气泡;随后加入 ,固体溶解,气泡产生明显减弱。结合方程式解释原因
,固体溶解,气泡产生明显减弱。结合方程式解释原因_______ 。
(5)综上, 做氧化剂还是做还原剂,与
做氧化剂还是做还原剂,与_______ 等因素有关。
 氧化性、还原性的变化规律。
氧化性、还原性的变化规律。资料:
 、
、
(1)制备
 :将
:将 溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀 ,得溶液B。溶
,得溶液B。溶 用冰水,目的是
用冰水,目的是(2)检验
 :向溶液A、B中分别滴加适量酸性
:向溶液A、B中分别滴加适量酸性 溶液。
溶液。Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
 发生还原反应:
发生还原反应:
 发生氧化反应:
发生氧化反应:Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含
 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:猜想1.
 有氧化性,能被还原为
有氧化性,能被还原为
猜想2.
 有
有 反应产生
反应产生
猜想3.……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| ⅰ | 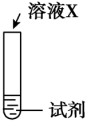 | a | 生成棕褐色固体,产生大量气泡 |
| ⅱ | b | 有少量气泡 | |
| ⅲ |  溶液 溶液 | 有少量气泡 |
①X是
②a是
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。
(4)向一定浓度的
 溶液中加入少量
溶液中加入少量 ,迅速产生大量气泡;随后加入
,迅速产生大量气泡;随后加入 ,固体溶解,气泡产生明显减弱。结合方程式解释原因
,固体溶解,气泡产生明显减弱。结合方程式解释原因(5)综上,
 做氧化剂还是做还原剂,与
做氧化剂还是做还原剂,与
您最近一年使用:0次
2022-05-19更新
|
410次组卷
|
3卷引用:热点1物质性质探究类实验
6 . 下列实验操作及现象与对应结论不匹配的是
| 选项 | 实验操作及现象 | 结论 |
| A | 将Na2S2O3溶液和稀H2SO4混合,得到沉淀,且生成的气体可使品红溶液褪色 | Na2S2O3既体现还原性又体现氧化性 |
| B | 将Zn(OH)2固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 | Zn(OH)2既体现碱性又体现酸性 |
| C | 将TiCl4液体和FeCl3固体分别暴露在潮湿空气中,只有前者会冒“白烟” | 水解性:TiCl4>FeCl3 |
| D | 将红色固体CrO3加热,得到绿色固体Cr2O3,且生成的气体可以使带火星的木条复燃 | 热稳定性:CrO3<Cr2O3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-22更新
|
4644次组卷
|
7卷引用:专题11 化学实验基础-2022年高考真题模拟题分项汇编
(已下线)专题11 化学实验基础-2022年高考真题模拟题分项汇编(已下线)2022年重庆高考真题化学试题变式题(选择题6-10)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2022年重庆高考真题化学试题黑龙江省七台河市勃利县高级中学2023-2024学年高三上学期9月月考化学试题
12-13高一上·黑龙江大庆·期末
名校
7 . 物质在反应中可表现氧化性、还原性、酸性、碱性等,下面方程式中划线的物质,能在同一反应中同时表现上述两种或两种以上性质的有( )
①3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O
②C + 2H2SO4(浓) = CO2 + 2SO2 + 2H2O
③8NH3 + 3Cl2 =6NH4Cl + N2
④2Na2O2 + 2H2O =4NaOH + O2
①3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O
②C + 2H2SO4(浓) = CO2 + 2SO2 + 2H2O
③8NH3 + 3Cl2 =6NH4Cl + N2
④2Na2O2 + 2H2O =4NaOH + O2
| A.①② | B.①④ | C.③④ | D.全部 |
您最近一年使用:0次
2020-10-24更新
|
123次组卷
|
15卷引用:二轮复习 专题6 非金属及其化合物 押题专练
(已下线)二轮复习 专题6 非金属及其化合物 押题专练(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(押题专练)(已下线)2011—2012学年度黑龙江大庆实验中学高一上学期期末考试化学试卷(已下线)2011-2012学年河北省邯郸市高一下学期期末教学质量检测化学试卷(已下线)2012-2013学年黑龙江省集贤县第一中学高一上学期期末考试化学试卷(已下线)2015届福建省三明一中高三学年度上学期第一次月考化学试卷(已下线)2015届福建省三明一中高三上学期第一次月考化学试卷2016届湖南省衡阳市第八中学高三上学期第二次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷湖南省邵东县第一中学2017届高三上学期第三次月考化学试题福建省龙海市第二中学2016-2017学年高二下学期期末考试化学试题浙江省余姚中学2020-2021学年高二上学期10月质量检测化学试题浙江省宁波市余姚中学2020-2021学年高一上学期10月质量检测化学试题宁夏回族自治区中卫市海原县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)【浙江新东方】62
2015·陕西渭南·一模
8 . 三氧化砷,俗称砒霜,分子式As2O3,是最具商业价值的砷化合物及主要的砷化学开始物料。它也是最古老的毒物之一,无臭无味,外观为白色霜状粉末,故称砒霜。
(1)完成并配平下列化学方程式:___ As2O3+___ Zn+___ H2SO4→___ AsH3+___ ZnSO4+___
(2)As2O3在上述反应中显示出来的性质是___ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.2molAsH3,则转移电子的物质的量为___ mol。
(4)砷化氢AsH3是一种很强的还原性,在室温下它能在空气中自然,其氧化产物是砒霜,写出该反应的化学方程式___ 。
(1)完成并配平下列化学方程式:
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.2molAsH3,则转移电子的物质的量为
(4)砷化氢AsH3是一种很强的还原性,在室温下它能在空气中自然,其氧化产物是砒霜,写出该反应的化学方程式
您最近一年使用:0次
2020-03-21更新
|
335次组卷
|
4卷引用:专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)2015届陕西省渭南市高三教学质量检测(一模)化学试卷上海市六校联考2015-2016学年高三上学期期中考试化学试题沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题
9 . 已知HNO2在低温下较稳定,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表,且酸性: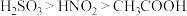 。下列有关说法
。下列有关说法错误 的是

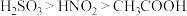 。下列有关说法
。下列有关说法

| pH范围 |  |  |
| 产物 |  | NO、 、 、 中的一种 中的一种 |
A.碱性条件下,NaNO2与NaClO反应的离子方程式为 |
| B.向冷的NaNO2溶液中通入H2S气体,有淡黄色沉淀产生 |
| C.低温时不用其它试剂即可区分HNO2溶液与Na2CO3溶液 |
| D.向冷的NaNO2溶液中通入SO2可得到HNO2 |
您最近一年使用:0次
10 . 小组同学探究不同条件下氯气与二价锰化合物的反应,实验记录如下:
资料:水溶液中, 为白色沉淀,
为白色沉淀, 呈绿色;浓碱性条件下,
呈绿色;浓碱性条件下, 可被
可被 还原为
还原为 ;
; 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
下列说法不正确 的是
| 序号 | 实验方法 | 实验现象 | |
| 实验装置 | 试剂a | ||
| ① |
| 水 | 产生黑色沉淀,放置后不发生变化 |
| ② | 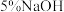 溶液 溶液 | 产生黑色沉淀,放置后溶液变为紫色,仍有沉淀 | |
| ③ | 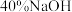 溶液 溶液 | 产生黑色沉淀,放置后溶液变为紫色,仍有沉淀 | |
| ④ | 取③中放置后的悬浊液 ,加入 ,加入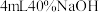 溶液 溶液 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | |
 为白色沉淀,
为白色沉淀, 呈绿色;浓碱性条件下,
呈绿色;浓碱性条件下, 可被
可被 还原为
还原为 ;
; 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。下列说法
| A.对比实验①和②可知,碱性环境中,二价锰化合物可被氧化到更高价态 |
B.④中溶液紫色迅速变为绿色的可能原因是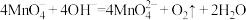 |
C.④中绿色缓慢加深的可能原因是 被 被 氧化为 氧化为 |
D.③中末得到绿色溶液,可能是因为 被氧化为 被氧化为 的反应速率快于 的反应速率快于 被还原为 被还原为 的反应速率 的反应速率 |
您最近一年使用:0次
2023-01-07更新
|
317次组卷
|
10卷引用:北京市海淀区2023届高三上学期期末考试变式汇编(8-14)
(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(8-14)北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题北京市顺义区第一中学2023-2024学年高二上学期10月月考化学试题北京市海淀区2023-2024学年高二上学期期中考试化学试题北京交通大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第二十中学2023-2024学年高三上学期10月月考化学试题北京市房山区房山中学2023-2024学年高二上学期期中学业水平调研化学试题北京市第十三中学2023-2024学年高三下学期开学测试化学试题