名校
1 . 利用废电池材料 (含炭黑及少量
(含炭黑及少量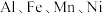 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下: 如下表:
如下表:
②电极电位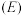 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应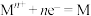 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。
酸性条件: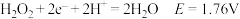 ;
;
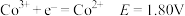
碱性条件: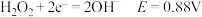 ;
;
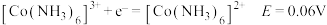
③丁二酮肟是不溶于水的固体,溶于乙醇后可与 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。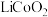 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为______ ,滤渣1为______ 。
(2)“氧化调 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有______ ,调节 范围为
范围为______ 。
(3)“转化”时,加入浓氨水将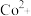 转化为
转化为 的原因是
的原因是______ ,加 目的是
目的是______ 。
(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是______ 。
(5)由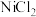 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式______ 。
(6)由 制备得一种锂离子电池材料
制备得一种锂离子电池材料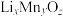 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则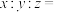
______ 。
 (含炭黑及少量
(含炭黑及少量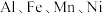 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下:
 如下表:
如下表:氢氧化物 |
|
|
|
|
完全沉淀 | 9.2 | 1.3 | 4.7 | 3.1 |
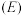 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应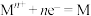 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。酸性条件:
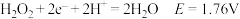 ;
;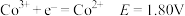
碱性条件:
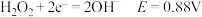 ;
;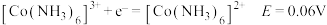
③丁二酮肟是不溶于水的固体,溶于乙醇后可与
 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。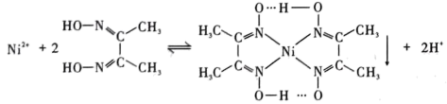
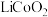 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为(2)“氧化调
 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有 范围为
范围为(3)“转化”时,加入浓氨水将
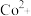 转化为
转化为 的原因是
的原因是 目的是
目的是(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是
(5)由
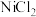 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式(6)由
 制备得一种锂离子电池材料
制备得一种锂离子电池材料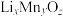 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则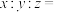

您最近一年使用:0次
2024-05-16更新
|
162次组卷
|
2卷引用:2024届重庆市南开中学校高三下学期5月月考化学试题
名校
解题方法
2 . 某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
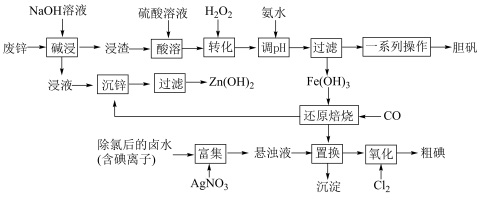
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: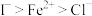
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为___________ 。
(2)“转化”中,加入足量 的目的是
的目的是___________ 。
(3)“调pH”时需控制该溶液的pH范围为___________ 之间。“调pH”之后,需要加热煮沸10min,冷却后再“过滤”。煮沸10min的作用是___________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为___________ 。
(5)“置换”反应的离子方程式为___________ 。
(6)“氧化”过程中若反应物用量比 时,氧化产物为
时,氧化产物为___________ (填化学式):当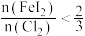 时,单质碘的收率会降低,原因是
时,单质碘的收率会降低,原因是 会将碘氧化为
会将碘氧化为 ,写出该反应的化学方程式
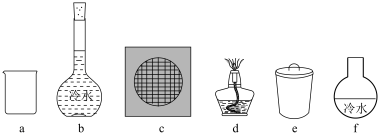
,写出该反应的化学方程式___________ 。采用升华法可精制粗碘,该过程需选择下列仪器中的___________ (填序号,夹持装置略)。
(7)胆矾结晶水测定:
①称量干燥坩埚的质量为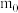 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为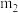 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为___________ (写表达式)。
②下列操作中,会导致结晶水数目测定值偏低的是___________ (填标号)。
a.实验前胆矾未充分干燥
b.加热时有少量胆矾迸溅出来
c.加热时部分样品由白色变为黑色
d.加热后的 放在空气中冷却后称量
放在空气中冷却后称量
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
| 沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
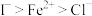
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量
 的目的是
的目的是(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“置换”反应的离子方程式为
(6)“氧化”过程中若反应物用量比
 时,氧化产物为
时,氧化产物为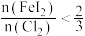 时,单质碘的收率会降低,原因是
时,单质碘的收率会降低,原因是 会将碘氧化为
会将碘氧化为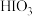 ,写出该反应的化学方程式
,写出该反应的化学方程式
(7)胆矾结晶水测定:
①称量干燥坩埚的质量为
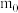 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为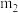 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为②下列操作中,会导致结晶水数目测定值偏低的是
a.实验前胆矾未充分干燥
b.加热时有少量胆矾迸溅出来
c.加热时部分样品由白色变为黑色
d.加热后的
 放在空气中冷却后称量
放在空气中冷却后称量
您最近一年使用:0次
名校
解题方法
3 . 硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,在有机合成中被称为“万能还原剂”。制备硼氢化钠的流程如图:
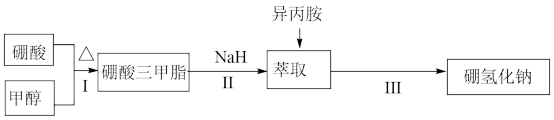
步骤Ⅰ:硼酸三甲酯[B(OCH3)3]的制备。将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图所示(夹持装置略去,下同)。已知:硼酸三甲酯能与水或水蒸气反应。
(1)直形冷凝管冷却水应从_______ (填“b”或“c”)接口进入。
(2)浓硫酸的作用是_______ 。
(3)图中圆底烧瓶中主要的反应化学方程式为_______ 。
(4)U形管中碱石灰的作用是_______ 。
步骤Ⅱ:NaBH4的制备。在240℃条件下,硼酸三甲酯[B(OCH3)3]与NaH反应制取NaBH4,同时生成CH3ONa。
步骤Ⅲ:分离提纯NaBH4。已知:NaBH4可溶于异丙胺(熔点:-101℃,沸点:33℃),甲醇钠(沸点:450℃)不溶于异丙胺。萃取时可采用索氏提取法,其装置如图所示。实验时将步骤Ⅱ的产物放入滤纸套筒1中,烧瓶中溶剂受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。
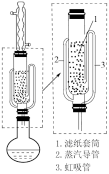
(5)当萃取完全后,硼氢化钠在_______ (填“圆底烧瓶”或“索氏提取器”)中。
(6)分离NaBH4并回收溶剂,采用的方法是_______ 。
(7)某同学欲通过硼氢化钠与水反应生成氢气的体积来测定硼氢化钠产品的纯度(杂质与水不反应)。已知硼氢化钠与水反应的化学方程式为NaBH4+2H2O=NaBO2+4H2↑。该同学称取0.7 g样品,测得生成气体的体积为1.4 L(已折算为标准状况),则样品中硼氢化钠的纯度为_______ %(结果保留两位有效数字)。

步骤Ⅰ:硼酸三甲酯[B(OCH3)3]的制备。将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图所示(夹持装置略去,下同)。已知:硼酸三甲酯能与水或水蒸气反应。

(1)直形冷凝管冷却水应从
(2)浓硫酸的作用是
(3)图中圆底烧瓶中主要的反应化学方程式为
(4)U形管中碱石灰的作用是
步骤Ⅱ:NaBH4的制备。在240℃条件下,硼酸三甲酯[B(OCH3)3]与NaH反应制取NaBH4,同时生成CH3ONa。
步骤Ⅲ:分离提纯NaBH4。已知:NaBH4可溶于异丙胺(熔点:-101℃,沸点:33℃),甲醇钠(沸点:450℃)不溶于异丙胺。萃取时可采用索氏提取法,其装置如图所示。实验时将步骤Ⅱ的产物放入滤纸套筒1中,烧瓶中溶剂受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。

(5)当萃取完全后,硼氢化钠在
(6)分离NaBH4并回收溶剂,采用的方法是
(7)某同学欲通过硼氢化钠与水反应生成氢气的体积来测定硼氢化钠产品的纯度(杂质与水不反应)。已知硼氢化钠与水反应的化学方程式为NaBH4+2H2O=NaBO2+4H2↑。该同学称取0.7 g样品,测得生成气体的体积为1.4 L(已折算为标准状况),则样品中硼氢化钠的纯度为
您最近一年使用:0次







