名校
解题方法
1 . 某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
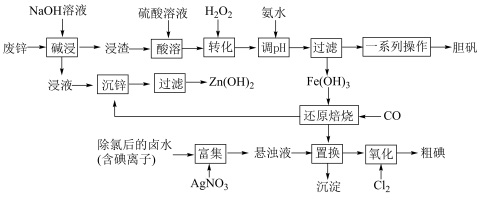
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: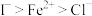
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为___________ 。
(2)“转化”中,加入足量 的目的是
的目的是___________ 。
(3)“调pH”时需控制该溶液的pH范围为___________ 之间。“调pH”之后,需要加热煮沸10min,冷却后再“过滤”。煮沸10min的作用是___________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为___________ 。
(5)“置换”反应的离子方程式为___________ 。
(6)“氧化”过程中若反应物用量比 时,氧化产物为
时,氧化产物为___________ (填化学式):当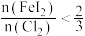 时,单质碘的收率会降低,原因是
时,单质碘的收率会降低,原因是 会将碘氧化为
会将碘氧化为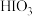 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。采用升华法可精制粗碘,该过程需选择下列仪器中的___________ (填序号,夹持装置略)。
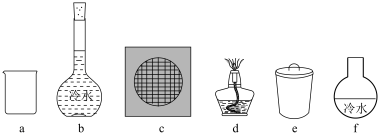
(7)胆矾结晶水测定:
①称量干燥坩埚的质量为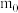 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为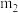 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为___________ (写表达式)。
②下列操作中,会导致结晶水数目测定值偏低的是___________ (填标号)。
a.实验前胆矾未充分干燥
b.加热时有少量胆矾迸溅出来
c.加热时部分样品由白色变为黑色
d.加热后的 放在空气中冷却后称量
放在空气中冷却后称量
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
| 沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量
 的目的是
的目的是(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“置换”反应的离子方程式为
(6)“氧化”过程中若反应物用量比
 时,氧化产物为
时,氧化产物为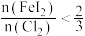 时,单质碘的收率会降低,原因是
时,单质碘的收率会降低,原因是 会将碘氧化为
会将碘氧化为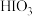 ,写出该反应的化学方程式
,写出该反应的化学方程式
(7)胆矾结晶水测定:
①称量干燥坩埚的质量为
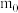 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为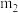 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为②下列操作中,会导致结晶水数目测定值偏低的是
a.实验前胆矾未充分干燥
b.加热时有少量胆矾迸溅出来
c.加热时部分样品由白色变为黑色
d.加热后的
 放在空气中冷却后称量
放在空气中冷却后称量
您最近一年使用:0次
2 . 某废合金的主要成分为Sn、Cu、Pb、Fe,一种综合回收的工艺流程如图所示:

已知:常温下,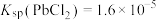 ,
, ,
, 。
。
回答下列问题:
(1)“氯化浸出”浸出液中金属阳离子主要有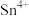 、
、 、
、_______ ;浸渣的主要成分为_______ (填化学式)。“氯化没出”时温度不宜过高或过低的原因是_______ 。
(2)写出“还原”中Fe与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)常温下,为使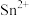 完全沉淀,“调pH”时应使溶液pH不低于
完全沉淀,“调pH”时应使溶液pH不低于_______ (结果保留1位小数)。
(4)“氧化”时为检验 是否已被充分氧化,可取样滴加
是否已被充分氧化,可取样滴加_______ (填化学式)溶液。
(5)写出“沉铁”时发生反应的离子反应方程式:_______ 。
(6) 受热后可制得物质A,写出物质A的一种用途:
受热后可制得物质A,写出物质A的一种用途:_______ 。

已知:常温下,
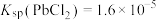 ,
, ,
, 。
。回答下列问题:
(1)“氯化浸出”浸出液中金属阳离子主要有
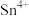 、
、 、
、(2)写出“还原”中Fe与
 反应的化学方程式:
反应的化学方程式:(3)常温下,为使
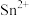 完全沉淀,“调pH”时应使溶液pH不低于
完全沉淀,“调pH”时应使溶液pH不低于(4)“氧化”时为检验
 是否已被充分氧化,可取样滴加
是否已被充分氧化,可取样滴加(5)写出“沉铁”时发生反应的离子反应方程式:
(6)
 受热后可制得物质A,写出物质A的一种用途:
受热后可制得物质A,写出物质A的一种用途:
您最近一年使用:0次
2023-02-27更新
|
604次组卷
|
2卷引用:重庆市乌江新高考协作体2023-2024学年高二上学期1月期末化学试题
名校
3 . 利用废旧白铁皮(含Fe、Zn、Fe2O3、ZnO)制备磁性Fe3O4胶体流程如图:

已知:锌及其化合物的性质与铝及其化合物的性质具有一定的相似性。
请回答:
(1)步骤Ⅰ碱溶的目的是去除油污,以及溶解镀锌层,写出NaOH溶液与ZnO反应的化学方程式_____ 。
(2)“部分氧化”阶段,ClO 被Fe2+还原为Cl-,该反应的离子方程式是
被Fe2+还原为Cl-,该反应的离子方程式是_____ 。
(3)经测定溶液B中Fe2+、Fe3+的物质的量之比是1∶2。检验其中Fe2+可选用的试剂是_____ (填字母)。
(4)用______ 效应可以确定溶液B中是否产生了Fe3O4胶体。
(5)步骤Ⅵ制备Fe3O4胶体装置如图1所示:

①持续通入N2的作用是______ 。
②实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和图2装置(净化装置略去),选出一种可行的方法,写出化学方程式_____ 。
可供选择的试剂:CuO(s)、NH3(g)、Cl2(g)、O2(g)、饱和NaNO2(aq)、饱和NH4Cl(aq)


已知:锌及其化合物的性质与铝及其化合物的性质具有一定的相似性。
请回答:
(1)步骤Ⅰ碱溶的目的是去除油污,以及溶解镀锌层,写出NaOH溶液与ZnO反应的化学方程式
(2)“部分氧化”阶段,ClO
 被Fe2+还原为Cl-,该反应的离子方程式是
被Fe2+还原为Cl-,该反应的离子方程式是(3)经测定溶液B中Fe2+、Fe3+的物质的量之比是1∶2。检验其中Fe2+可选用的试剂是
| A.NaOH溶液 | B.KSCN溶液 | C.KMnO4溶液 | D.K3[Fe(CN)6]溶液 |
(5)步骤Ⅵ制备Fe3O4胶体装置如图1所示:

①持续通入N2的作用是
②实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和图2装置(净化装置略去),选出一种可行的方法,写出化学方程式
可供选择的试剂:CuO(s)、NH3(g)、Cl2(g)、O2(g)、饱和NaNO2(aq)、饱和NH4Cl(aq)

您最近一年使用:0次
2023-01-15更新
|
427次组卷
|
2卷引用: 重庆市第一中学校2022-2023学年高一上学期期末考试化学试题
名校
解题方法
4 . 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知: (橙色) +H2O
(橙色) +H2O
 (黄色) + 2H+
(黄色) + 2H+
(1)进行实验ⅰ和ⅱ:
①用离子方程式表示饱和Na2SO3溶液pH约为9的原因:______________________ 。
②用离子方程式解释i中现象:______________________ 。
(2)继续进行实验ⅲ:
为了说明产生上述现象的原因,补充实验ⅳ:
向2 mL蒸馏水中滴加pH=2的0.05 mol/L K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验ⅳ的目的是______________________ 。
②用化学平衡移动原理解释iii中现象:______________________ 。
③根据实验ⅰ~ⅲ,可推测:Na2SO3溶液和铬( VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬( VI)盐溶液不发生氧化还原反应;
b.______________________ 。
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是______________ 。
已知:
 (橙色) +H2O
(橙色) +H2O
 (黄色) + 2H+
(黄色) + 2H+(1)进行实验ⅰ和ⅱ:
| 序号 | 操作 | 现象 |
| ⅰ | 向2 mLpH=2的0.05 mol/LK2Cr2O7的橙色溶液中滴加饱和Na2SO3溶液(pH约为9)3滴 | 溶液变绿色(含Cr3+) |
| ⅱ | 向2 mLpH=8的0.1 mol/L的K2CrO4黄色溶液中滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
②用离子方程式解释i中现象:
(2)继续进行实验ⅲ:
| 序号 | 操作 | 现象 |
| ⅲ | 向2 mL饱和Na2SO3溶液中滴加pH=2的0.05 mol/LK2Cr2O7的橙色溶液3滴 | 溶液变黄色 |
向2 mL蒸馏水中滴加pH=2的0.05 mol/L K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验ⅳ的目的是
②用化学平衡移动原理解释iii中现象:
③根据实验ⅰ~ⅲ,可推测:Na2SO3溶液和铬( VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬( VI)盐溶液不发生氧化还原反应;
b.
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是
您最近一年使用:0次
2020-12-29更新
|
469次组卷
|
5卷引用:重庆市第三十二中学2020-2021学年高二上学期期末考试化学试题



