名校
解题方法
1 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是___________ ,具有___________ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作___________ (填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:___________ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为___________ 。
②装置C中观察到的现象是___________ ,反应的化学方程式是___________ 。
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是___________ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作
反应过程中氧化产物与还原产物的个数比为:
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为
②装置C中观察到的现象是
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是
您最近一年使用:0次
2021-03-21更新
|
588次组卷
|
4卷引用:重庆市南坪中学2020-2021学年高一上学期期中考试化学试题
重庆市南坪中学2020-2021学年高一上学期期中考试化学试题广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
名校
2 . 下列实验操作能达到相应实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 将C2H4和SO2的混合气体通入足量酸性KMnO4溶液中 | 得到纯净的C2H4 |
| B | 向NaCl饱和溶液中先通入NH3至饱和,再通入足量CO2,过滤并洗涤 | 制备NaHCO3固体 |
| C | 向含少量FeBr2的FeCl2溶液中滴入适量新制氯水,并加入CCl4萃取分液 | 制备纯净的FeC12溶液 |
| D | 向5mL 0.1mol/L AgNO3溶液中加入1mL 0.1mol/L NH3·H2O | 制备银氨溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-05-04更新
|
766次组卷
|
4卷引用:广东省华南师范大学附属中学2018届高三综合测试(三)理科综合化学试题
3 . 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如图。
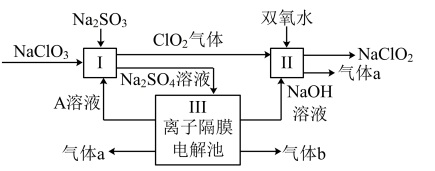
(1)I中发生反应的还原剂是___ (填化学式)。
(2)II中反应的离子方程式是___ 。
(3)A的化学式是___ ,装置III中A在___ 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应方程式为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是___ 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗FeSO4的物质的量___ (填“相等”或“不相等”)。

(1)I中发生反应的还原剂是
(2)II中反应的离子方程式是
(3)A的化学式是
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应方程式为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗FeSO4的物质的量
您最近一年使用:0次
2020-09-03更新
|
68次组卷
|
2卷引用:广东省广州英豪学校2020-2021学年高三上学期11月月考化学试题



