1 . 某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
(1)制取新制Cu(OH)2悬浊液的离子方程式为_________ 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:_________ 。检验Cu(OH)2洗涤干净的方法是_________ 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3) +Cl- + 2H2O 、
+Cl- + 2H2O 、 _________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式:_________ 。
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,__________ ,则说明砖红色沉淀是Cu2O。
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入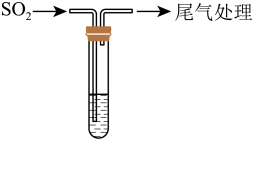 | 实验Ⅰ | 1.5 mL 1 mol·L-1 CuSO4溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
实验Ⅱ | 1.5 mL 1 mol·L-1 CuCl2溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)
 +Cl- + 2H2O 、
+Cl- + 2H2O 、 ②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,
您最近一年使用:0次
2 . 利用如图所示装置进行下列实验,不能 达到相应实验目的的是( )
| 选项 | ① | ② | ③ | 实验目的 |  |
| A | 稀硫酸 | Na2S | AgCl的浊液 | 验证Ag2S比AgCl难溶 | |
| B | 浓硝酸 | Cu片 | NaOH溶液 | 探究浓硝酸具有氧化性 | |
| C | 硫酸 | Na2SO3 | 酸性KMnO4溶液 | 探究SO2具有还原性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 验证酸性:硝酸>碳酸>硅酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 某小组研究FeCl3与Na2S的反应,设计了如下实验:
I.探究黑色沉淀的成分
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3。
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。b、c 中黑色沉淀部分变为红褐色。
(1)①同学甲认为实验a 中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是_____ 。
②同学乙认为实验b的黑色沉淀物中有FeS,则一定混有S,理由是_____ 。
③设计实验检验b的黑色沉淀物中混有硫。
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。

实验证明了b中黑色沉淀混有S,试剂a是_____ ,观察到的现象为________ 。
II.探究实验a中Fe3+与S2-没有发生氧化还原反应的原因经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨
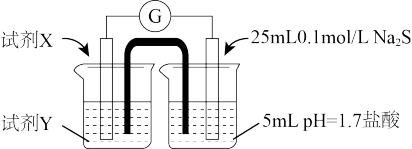
(2)①试剂X和Y分别是__________ 、_______ 。
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由_____ 。
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是_____ 。
④由此得出的实验结论是_____ 。
III.探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
(3)①用离子方程式解释实验1中的现象_____ 、_____ (写离子方程式)。
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因_____ 。
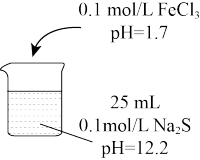 | 实验 a | 实验 b | 实验 c | |
| FeCl3体积 | 5 mL | 10 mL | 30 mL | |
| 实验现象 | 产生黑色浑浊,混合液pH=11.7 | 黑色浑浊度增大,混合液 pH=6.8 | 黑色浑浊比实验b明显减少,观察到大量黄色浑浊物,混合液 pH=3.7 |
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3。
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。b、c 中黑色沉淀部分变为红褐色。
(1)①同学甲认为实验a 中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是
②同学乙认为实验b的黑色沉淀物中有FeS,则一定混有S,理由是
③设计实验检验b的黑色沉淀物中混有硫。
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。

实验证明了b中黑色沉淀混有S,试剂a是
II.探究实验a中Fe3+与S2-没有发生氧化还原反应的原因经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨

(2)①试剂X和Y分别是
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是
④由此得出的实验结论是
III.探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
| 实验 1 | 实验 2 |
 固体溶解,闻到微量臭鸡蛋气味,溶液出现淡黄色浑浊。 |  |
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因
您最近一年使用:0次
2020-12-26更新
|
502次组卷
|
3卷引用:【区级联考】北京市丰台区2019届高三第二学期综合练习(一)(一模)化学试题
解题方法
4 . 化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___ (填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__ ,该条件下氧化性:Fe3+__ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____ 。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___ ,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。
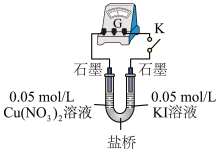
K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___ (填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____ 。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实验 | 现象 | ||
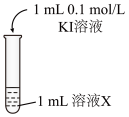 | 编号 | 溶液X | |
| Ⅰ | 0.1mol/LFe(NO3)3,pH≈1 | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
| Ⅱ | KNO3和HNO3,其中c( )=0.3mol/L,pH≈1 )=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
| Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
| Ⅳ | 0.1mol/LCu(NO3)2 | 5秒钟后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
①由“黄色立即加深”初步判断有I2生成,选择
②写出Fe3+与I-反应的离子方程式
③实验Ⅱ的目的是
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。

K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是
您最近一年使用:0次
名校
解题方法
5 . 利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色近白色难溶于水的固体),对现象的描述或解释有错误的是
| 实验 | 装置 | 试剂a | 现象 |
| ① | 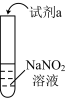 | 酚酞 | 无色溶液变红 |
| ② | AgNO3溶液 | 产生淡黄色近白色沉淀 | |
| ③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
| ④ | 酸性K2Cr2O7溶液 | 溶液变为绿色 |
A.NaNO2溶液呈碱性:NO +H2O ⇌HNO2+OH- +H2O ⇌HNO2+OH- |
B.NaNO2可与某些盐发生复分解反应:NO +Ag+=AgNO2↓ +Ag+=AgNO2↓ |
C.NaNO2具有氧化性:2I-+2H++2NO =I2+2NO2↑+H2O =I2+2NO2↑+H2O |
D.NaNO2具有还原性:Cr2O +3NO +3NO +8H+=3NO +8H+=3NO +2Cr3++4H2O +2Cr3++4H2O |
您最近一年使用:0次
2021-01-12更新
|
594次组卷
|
12卷引用:北京市海淀区2019-2020学年高三期中考试化学试题
北京市海淀区2019-2020学年高三期中考试化学试题2020届高三化学海淀区高三第一学期期中练习重庆南开中学高2020届高三11月月考理综化学试题山西省长治市第二中学2019-2020学年高二上学期12月月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》重庆市南开中学2020届高三年级网课学习能力自测理科综合化学试题浙江省诸暨市2019-2020学年高二上学期期末考试化学试题天津市第四十七中学2020~2021学年高三模拟考试化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市中国人民大学附属中学2023-2024学年高三上学期期中考试前练习化学试题四川省成都市第七中学2023届高三上学期零诊模拟考试化学试题天津北京师范大学静海附属学校 (天津市静海区北师大实验学校)2023-2024学年高三上学期第二次阶段检测(期中)化学试题



