名校
解题方法
1 . 下列实验过程可以达到实验目的的是
选项 | 实验目的 | 实验过程 |
A | 检验久置的Na2SO3粉末是否变质 | 取样配成溶液,加入盐酸酸化,再加氯化钡溶液,观察到有白色沉淀产生 |
B | 制备纯净的FeCl2 | 向含少量FeBr2的FeCl2溶液中滴入适量新制氯水,并加入CCl4萃取分液 |
C | 制备银氨溶液 | 向5mL0.1mol•L-1 AgNO3 溶液中加入1mL0.1mol•L-1 NH3•H2O |
D | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-03-03更新
|
286次组卷
|
3卷引用:山东省六地市部分学校2020届高三下学期3月2日线上考试化学试题
山东省六地市部分学校2020届高三下学期3月2日线上考试化学试题山东省实验中学2020届高三线上诊断测试化学试题(已下线)考点22 实验探究与方案设计型综合实验-2020年高考化学命题预测与模拟试题分类精编
名校
解题方法
2 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是___________ ,具有___________ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作___________ (填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:___________ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为___________ 。
②装置C中观察到的现象是___________ ,反应的化学方程式是___________ 。
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是___________ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作
反应过程中氧化产物与还原产物的个数比为:
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为
②装置C中观察到的现象是
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是
您最近一年使用:0次
2021-03-21更新
|
585次组卷
|
4卷引用:重庆市南坪中学2020-2021学年高一上学期期中考试化学试题
重庆市南坪中学2020-2021学年高一上学期期中考试化学试题黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题
名校
3 . 工业上常用亚硝酸钠 作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备
作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备 并探究NO、
并探究NO、 的某一化学性质
的某一化学性质 中加热装置已略去
中加热装置已略去 。请回答下列问题:
。请回答下列问题:

已知:①2NO+Na2O2=2NaNO2
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+
(1)装置A三颈烧瓶中发生反应的化学方程式为____________ 。
(2)用上图中的装置制备 ,其连接顺序为:
,其连接顺序为:
___ 
____ 
___ 
___ 
___ 
___  按气流方向,用小写字母表示
按气流方向,用小写字母表示 ,此时活塞
,此时活塞 、
、 如何操作
如何操作____________ 。
(3) 装置发生反应的离子方程式是
装置发生反应的离子方程式是________________ 。
(4)通过查阅资料, 或NO可能与溶液中
或NO可能与溶液中 发生反应。某同学选择上述装置并按
发生反应。某同学选择上述装置并按 顺序连接,E中装入
顺序连接,E中装入 溶液,进行如下实验探究。
溶液,进行如下实验探究。
步骤②操作的目的是___________ ;步骤③C瓶中发生的化学方程式为_________________ ;通过实验可以得出:___________  填“
填“ 、NO中的一种或两种”
、NO中的一种或两种” 和溶液中
和溶液中 发生反应使溶液呈深棕色。
发生反应使溶液呈深棕色。
 作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备
作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备 并探究NO、
并探究NO、 的某一化学性质
的某一化学性质 中加热装置已略去
中加热装置已略去 。请回答下列问题:
。请回答下列问题:
已知:①2NO+Na2O2=2NaNO2
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+
(1)装置A三颈烧瓶中发生反应的化学方程式为
(2)用上图中的装置制备
 ,其连接顺序为:
,其连接顺序为:





 按气流方向,用小写字母表示
按气流方向,用小写字母表示 ,此时活塞
,此时活塞 、
、 如何操作
如何操作(3)
 装置发生反应的离子方程式是
装置发生反应的离子方程式是(4)通过查阅资料,
 或NO可能与溶液中
或NO可能与溶液中 发生反应。某同学选择上述装置并按
发生反应。某同学选择上述装置并按 顺序连接,E中装入
顺序连接,E中装入 溶液,进行如下实验探究。
溶液,进行如下实验探究。 | 步骤 | 操作及现象 |
| ① | 关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色。 |
| ② | 停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间 |
| ③ | 更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同 |
步骤②操作的目的是
 填“
填“ 、NO中的一种或两种”
、NO中的一种或两种” 和溶液中
和溶液中 发生反应使溶液呈深棕色。
发生反应使溶液呈深棕色。
您最近一年使用:0次
名校
4 . 叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮
化钠的工艺流程:

已知 NaN3能与 AgNO3反应生成白色难溶于水的 AgN3;Ag2CrO4呈红色,可溶于水。有关物质的物理性质如下表:
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为_____ ;步骤Ⅱ中生成 NaN3的化学方程式为_____
(2)实验室模拟步骤Ⅱ实验装置如图(装置中冷却水省略,下同):根据实验发现温度在 20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此需要采取的措施是_____ 。
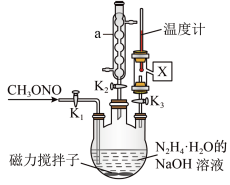
(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液 A 进行蒸馏的合理操作顺序是_____ 。
①打开 K1、K2,关闭 K3 ②打开 K3 ③加热 ④关闭 K1、K2
(4)步骤Ⅳ对溶液B 加热蒸发至溶液体积的 1/3,NaN3结晶析出。
①步骤Ⅴ最好选用_____ 洗涤晶体。
A.水 B.乙醇 C.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色 K2CrO4溶液作指示剂,将 AgNO3标准溶液滴入样品溶液, 滴定终点现象为_________ 。AgNO3溶液要装在_____ 滴定管里进行滴定。下列说法正确的是_____ 。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若发现滴液过量,可回滴样品溶液
E.若未等滴定管液面稳定就读数会导致测定结果偏高
化钠的工艺流程:

已知 NaN3能与 AgNO3反应生成白色难溶于水的 AgN3;Ag2CrO4呈红色,可溶于水。有关物质的物理性质如下表:
| 熔点℃ | 沸点℃ | 溶解性 | |
| CH3OH | -9 | 64.7 | 与水互溶 |
| 水合肼(N2H4•H2O) | 2 | 113.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
| 亚硝酸甲酯(CH3ONO) | -17 | -12 | 难溶于水,可溶于乙醇、乙醚 |
| NaN3 | 275 | 300 | 易溶于水,难溶于乙醇 |
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为
(2)实验室模拟步骤Ⅱ实验装置如图(装置中冷却水省略,下同):根据实验发现温度在 20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此需要采取的措施是

(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液 A 进行蒸馏的合理操作顺序是
①打开 K1、K2,关闭 K3 ②打开 K3 ③加热 ④关闭 K1、K2
(4)步骤Ⅳ对溶液B 加热蒸发至溶液体积的 1/3,NaN3结晶析出。
①步骤Ⅴ最好选用
A.水 B.乙醇 C.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色 K2CrO4溶液作指示剂,将 AgNO3标准溶液滴入样品溶液, 滴定终点现象为
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若发现滴液过量,可回滴样品溶液
E.若未等滴定管液面稳定就读数会导致测定结果偏高
您最近一年使用:0次
名校
解题方法
5 . MnO2是制造干电池的主要原料之一,也是中学化学中常见的一种试剂。工业上Mn(NO3)2和KMnO4为原料制备MnO2,其生产原理如下:用软锰矿(含MnO2和少量的Fe2O3、SiO2)和碳反应制得MnO;再将MnO与稀硝酸反应,反应后经过滤、提纯、浓缩,可制得50%的Mn(NO3)2溶液;在一定条件下,把50%的Mn(NO3)2溶液滴加到KMnO4溶液中,发生如下反应:3Mn(NO3)2+2KMnO4+2H2O═5MnO2↓+2KNO3+4HNO3,反应生成的沉淀经过滤、洗涤、干燥后得到MnO2。

请回答下列问题:
Ⅰ、若将软锰矿和碳反应后的固体产物置于如图1所示的装置甲中,与稀硝酸反应,观察到装置乙中有红棕色气体产生。
(1)写出甲中产生气体反应的化学方程式___ 。
(2)在制备MnO2的实验中要向反应混合液中不断滴加氨水,则氨水的作用是___ 。
Ⅱ、有人提出用日光分解KMnO4溶液的方法可制取MnO2,反应方程式为:4KMnO4+2H2O 4MnO2↓+4KOH+3O2↑该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是
4MnO2↓+4KOH+3O2↑该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是___ 。
Ⅲ、某兴趣小组通过实验研究MnO2的氧化性进行了一系列的研究。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是___ 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
该小组从上述对比实验中,可以得出的结论是___ 。写出在MnO2迅速氧化I−的离子方程式___ 。

请回答下列问题:
Ⅰ、若将软锰矿和碳反应后的固体产物置于如图1所示的装置甲中,与稀硝酸反应,观察到装置乙中有红棕色气体产生。
(1)写出甲中产生气体反应的化学方程式
(2)在制备MnO2的实验中要向反应混合液中不断滴加氨水,则氨水的作用是
Ⅱ、有人提出用日光分解KMnO4溶液的方法可制取MnO2,反应方程式为:4KMnO4+2H2O
 4MnO2↓+4KOH+3O2↑该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是
4MnO2↓+4KOH+3O2↑该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是Ⅲ、某兴趣小组通过实验研究MnO2的氧化性进行了一系列的研究。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
您最近一年使用:0次
6 . 氧化铅( PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为:H2C2O4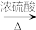 CO↑+CO2↑+H2O。某课题组同学设计实验探究CO 还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO 还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是

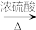 CO↑+CO2↑+H2O。某课题组同学设计实验探究CO 还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO 还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是
| A.装置②④⑤中的试剂依次为碱石灰、银氨溶液、澄清石灰水 |
| B.实验时,先点燃装置①处酒精灯,当装置⑤中产生连续气泡且有明显现象后再点燃装置③处酒精灯 |
| C.实验完毕时,先熄灭装置①处酒精灯,再熄灭装置③处酒精灯 |
| D.尾气处理可选用点燃、气袋收集、NaOH 溶液吸收等方法 |
您最近一年使用:0次
2018-10-15更新
|
164次组卷
|
4卷引用:【全国市级联考】河南省洛阳市2018届高三下学期尖子生第二次联考化学试题
7 . 某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
(1)制取新制Cu(OH)2悬浊液的离子方程式为_________ 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:_________ 。检验Cu(OH)2洗涤干净的方法是_________ 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3) +Cl- + 2H2O 、
+Cl- + 2H2O 、 _________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式:_________ 。
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,__________ ,则说明砖红色沉淀是Cu2O。
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入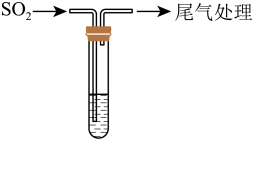 | 实验Ⅰ | 1.5 mL 1 mol·L-1 CuSO4溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
实验Ⅱ | 1.5 mL 1 mol·L-1 CuCl2溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)
 +Cl- + 2H2O 、
+Cl- + 2H2O 、 ②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,
您最近一年使用:0次
解题方法
8 . 某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是___________ 。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
实验结论:_________________________________ 。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:_____ 。(填序号)
A、Cl2 B、Na C、Na+ D、Cl- E、SO2 F、盐酸
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 |  | Zn+Fe2+=Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 | |
| ④ |  | Fe3+具有氧化性 |
实验结论:
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:
A、Cl2 B、Na C、Na+ D、Cl- E、SO2 F、盐酸
您最近一年使用:0次
名校
9 . 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 移取15.00 mLKI溶液 | 向20 mL量筒加入KI溶液至刻度线15处,然后倒出 |
| B | 制取并纯化SO2 | 将浓硫酸滴入Na2SO3中,生成的气体依次通过饱和NaHCO3溶液、浓硫酸 |
| C | 比较BaSO4和BaSO3的Ksp | 向盛有BaCl2溶液的试管中先加入Na2SO3溶液,然后加入Na2SO4,观察现象 |
| D | 探究H2O2的还原性 | 向盛有2mL酸性KMnO4溶液的试管中滴加浓的H2O2溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-05-06更新
|
212次组卷
|
3卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期期中考试化学试题
10 . 利用如图所示装置进行下列实验,不能 达到相应实验目的的是( )
| 选项 | ① | ② | ③ | 实验目的 |  |
| A | 稀硫酸 | Na2S | AgCl的浊液 | 验证Ag2S比AgCl难溶 | |
| B | 浓硝酸 | Cu片 | NaOH溶液 | 探究浓硝酸具有氧化性 | |
| C | 硫酸 | Na2SO3 | 酸性KMnO4溶液 | 探究SO2具有还原性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 验证酸性:硝酸>碳酸>硅酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



