1 . 某同学为验证Fe3+的氧化性进行了如下实验:
已知相同条件下AgCl的溶解度小于Ag2SO4.下列说法不正确的是
| 序号 | 操作 | 现象 |
| 实验I | 将2 mL 2 mol∙L−1Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验II | 将2 mL1 mol∙L−1 Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验III | 将2mL2 mol∙L−1FeCl3溶液加入有银镜的试管中 | 银镜消失 |
| 实验IV | 将2mL 1 mol∙L−1 AgNO3溶液加入到1 mL 1 mol∙L−1 FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| A.实验I不能说明Fe3+氧化了Ag |
B.实验II和III说明溶液中存在平衡: Fe3++Ag Fe2++ Ag+ Fe2++ Ag+ |
| C.实验IV中产生白色沉淀,说明Ag+氧化了Fe2+ |
| D.欲证明实验IV中产生了Fe3+,可以取上层清液滴加KSCN溶液 |
您最近一年使用:0次
13-14高三上·北京海淀·期中
名校
2 . 已知下列实验事实:
① 固体既能溶于KOH溶液得到
固体既能溶于KOH溶液得到 溶液,又能溶于硫酸得到
溶液,又能溶于硫酸得到 溶液;
溶液;
②向 溶液中滴加
溶液中滴加 溶液,再酸化,可得
溶液,再酸化,可得 溶液;
溶液;
③将 溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
①
 固体既能溶于KOH溶液得到
固体既能溶于KOH溶液得到 溶液,又能溶于硫酸得到
溶液,又能溶于硫酸得到 溶液;
溶液;②向
 溶液中滴加
溶液中滴加 溶液,再酸化,可得
溶液,再酸化,可得 溶液;
溶液;③将
 溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。下列判断不正确的是
A.化合物 中Cr元素为+3价 中Cr元素为+3价 |
B.实验①证明 是两性氧化物 是两性氧化物 |
C.实验②证明 既有氧化性又有还原性 既有氧化性又有还原性 |
D.实验③证明氧化性: |
您最近一年使用:0次
2022-11-29更新
|
313次组卷
|
37卷引用:2014届北京市海淀区高三上学期期中考试化学试卷
(已下线)2014届北京市海淀区高三上学期期中考试化学试卷(已下线)2015届福建省厦门双十中学高三上学期期中化学试卷(已下线)2015届江西省新余一中高三上学期第三次模拟化学试卷2015届河北省冀州中学高三上学期期中化学A试卷2015届四川省高三“联测促改”活动第二轮测试理综化学试卷2016届河南省西华县第一高级中学高三上学期10月联考化学试卷2016届福建省大田县第一中学高三上学期期中考试化学试卷2015-2016学年江苏省镇江中学高一上学期期中考试化学试卷2016届河南省洛阳市高三上学期12月统考化学试卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2017届福建省南安一中高三暑假阶段性考试化学试卷2017届山东省淄博市淄川一中高三上学期第一次月考化学试卷2017届河北省定州中学高三上学期第二次月考化学试卷2016-2017学年河北省武邑中学高二上学期第二次月考化学试卷2017届山东省莱州一中高三上第一次质检化学试卷黑龙江省牡丹江市第一高级中学2016-2017学年高二6月月考化学试题苏教版2017届高三单元精练检测二化学试题黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期末考试化学试题北京市清华大学附属中学2016-2017学年高一下学期期中考试化学试题江西省抚州市临川区第一中学2018届高三上学期期中考试化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一12月月考化学试题黑龙江省哈尔滨六中2017-2018学年高一12月月考化学试卷(已下线)北京四中2018届上学期高三年级期中考试化学试卷天津市滨海新区大港油田一中2019届高三上学期期中考试化学试题【全国百强校】北京市北京四中2019届高三上学期期中考试化学试题河北省沧州市泊头市第一中学2020届高三上学期第二次月考化学试题云南省曲靖二中2020届高三第一次月考理综化学试题(已下线)【南昌新东方】江西省九江市第一中学2015-2016学年高一上学期第二次(12月)月考化学试题(已下线)【南昌新东方】江西省九江一中2015-2016学年高一上学期第二次月考化学试卷北京师范大学附属实验中学 2019-2020 学年高一下学期 AR 层线上测试化学试题广东省珠海市第二中学2021届高三10月月考化学试题江西省兴国三中2021届高三上学期第一次月考化学试题安徽省泗县第一中学2022届高三上学期开学考试化学试题江西省樟树航天中学高三年级2021-2022学年高三上学期10月调研考试化学试题重庆南开中学2022-2023学年高一上学期期中考试化学试题广东省惠州市惠阳区中山中学2021-2022学年高一上学期第三次月考质量检测化学试题(已下线)第4讲 氧化还原反应的基本概念与规律
3 . 已知下述三个实验均能发生化学反应:
下列判断正确的是
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A.上述①和③中的铁钉只作还原剂 |
| B.上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
| C.实验②中Fe2+既显氧化性又显还原性 |
| D.实验③中反应的离子方程式为Fe+Fe3+=2Fe2+ |
您最近一年使用:0次
2021-10-23更新
|
172次组卷
|
9卷引用:黑龙江省哈尔滨市第六中学2017-2018学年高一12月月考化学试题
名校
4 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是___________(填字母代号)。
(2)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是___________ nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:首先取少量待测溶液﹐滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是___________ ,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,___________ (填实验操作,下同)、___________ 、干燥,称量沉淀质量为43.05g。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是___________ (填字母代号)。
A.向试管中加入试液,滴入KSCN溶液,若显红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
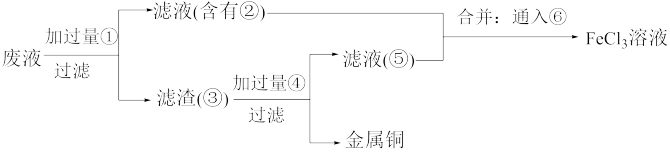
A.请写出上述实验中加入或生成的有关物质的化学式:①___________ ;②___________ ;③___________ ;④___________ 。
B.请写出通入⑥的化学方程式:___________ 。
(1)所含铁元素既有氧化性又有还原性的物质是___________(填字母代号)。
| A.Fe | B.FeCl2 | C.FeSO4 | D.Fe2O3 |
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(4)若要验证该溶液中含有Fe2+,正确的实验方法是
A.向试管中加入试液,滴入KSCN溶液,若显红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液,设计实验方案如下:

A.请写出上述实验中加入或生成的有关物质的化学式:①
B.请写出通入⑥的化学方程式:
您最近一年使用:0次
名校
5 . 双氧水和84消毒液是生活中常用的两种消毒剂,了解物质的性质是科学合理使用化学品的基础和前提,请回答下列问题:
(1)某同学设计如下实验研究H2O2的性质
①从理论上看H2O2既有氧化性又有还原性,原因是___________ 。
②能证明H2O2具有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母)。
(2)84消毒液的有效成分为NaClO;
①84消毒液不能和洁厕灵(主要成分为较高浓度的盐酸)混用,否则易产生有毒气体,反应的化学方程式为___________ 。
②巴西奥运会期间,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应中氧化性:NaClO___________ H2O2 (填“>”或“<”)。反应的离子反应方程式为___________ 。
(1)某同学设计如下实验研究H2O2的性质
| 序号 | 实验 | 实验现象 |
| ⅰ | 向5% H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ⅱ | 向5% H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
②能证明H2O2具有还原性的实验是
(2)84消毒液的有效成分为NaClO;
①84消毒液不能和洁厕灵(主要成分为较高浓度的盐酸)混用,否则易产生有毒气体,反应的化学方程式为
②巴西奥运会期间,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应中氧化性:NaClO
您最近一年使用:0次
名校
6 . FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
Ⅰ.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴, 为外套电炉丝的不锈钢管,
为外套电炉丝的不锈钢管, 是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至
是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至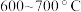 ,然后将干燥、纯净的CO2气流通入D中,
,然后将干燥、纯净的CO2气流通入D中, 管中反应开始。不断将d中液溴滴入温度为
管中反应开始。不断将d中液溴滴入温度为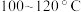 的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。
的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。


(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸,为使通入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中的试剂:B为___________ ,C为___________ 。为防止污染空气,实验时应在F处连接盛___________ 的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是①___________ ,②___________ 。
Ⅱ.探究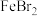 的还原性
的还原性
(3)实验需要90 mL0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是___________ 。
(4)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。假设1:Br-被Cl2氧化成Br2溶解在溶液中:假设2:Fe2+被Cl2氧化成Fe3+。设计实验证明假设2正确:___________ 。
(5)请用一个离子方程式来证明还原性Fe2+>Br-:___________ 。
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为___________ 。
Ⅰ.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,
 为外套电炉丝的不锈钢管,
为外套电炉丝的不锈钢管, 是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至
是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至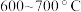 ,然后将干燥、纯净的CO2气流通入D中,
,然后将干燥、纯净的CO2气流通入D中, 管中反应开始。不断将d中液溴滴入温度为
管中反应开始。不断将d中液溴滴入温度为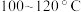 的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。
的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸,为使通入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中的试剂:B为
(2)反应过程中要不断通入CO2,其主要作用是①
Ⅱ.探究
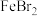 的还原性
的还原性(3)实验需要90 mL0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是
(4)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。假设1:Br-被Cl2氧化成Br2溶解在溶液中:假设2:Fe2+被Cl2氧化成Fe3+。设计实验证明假设2正确:
(5)请用一个离子方程式来证明还原性Fe2+>Br-:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为
您最近一年使用:0次
2021-08-05更新
|
260次组卷
|
5卷引用:2017届江西省上高二中高三上学期第三次月考化学试卷
2017届江西省上高二中高三上学期第三次月考化学试卷黑龙江省哈尔滨市第六中学2017届高三下学期第三次模拟考试理科综合化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题27 假设猜想型实验探究评价题重庆市第三十七中学校 2021-2022学年(2022届)高三上学期 7月月考化学试题天津市新华中学2022-2023学年高三上学期学科练习(一)化学试题
7 . 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
您最近一年使用:0次
2021-06-22更新
|
1611次组卷
|
19卷引用:四川省南充市阆中中学2020届高三化学选择题专项训练(12)
四川省南充市阆中中学2020届高三化学选择题专项训练(12)吉林油田高级中学2019-2020学年高二下学期期末考试化学试题云南省罗平县第五中学2020-2021学年高一上学期12月月考化学试题陕西省西安市长安区第一中学2020-2021学年高一上学期第二次月考化学试题福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题江西省赣州市信丰中学2020-2021学年高三上学期第二次月考化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题福建省武平县第一中学2020-2021学年高一上学期第二次阶段考试(实验班)化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题黑龙江省哈尔滨市德强高中2021-2022学年高一上学期期中考试化学试题新疆师范大学附属中学2021-2022学年高三9月月考化学试题云南省玉溪市通海县第一中学2021—2022学年高一上学期期末考试化学试题(已下线)1.3 氧化还原反应-同步学习必备知识黑龙江省黑河市第九中学2022-2023学年高三上学期摸底考试化学试题(已下线)2.2.1氯气的性质-同步学习必备知识 山东省济宁市兖州区2022-2023学年高一上学期期中考试化学试题福建省诏安县桥东中学2022-2023学年高三上学期期中考试化学试题云南省广南县第二中学校2021-2022学年高一下学期开学考试化学试题广东省云浮市罗定中学2023-2024学年高一上学期期中考试化学试题
8 . 某小组研究FeCl3与Na2S的反应,设计了如下实验:
I.探究黑色沉淀的成分
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3。
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。b、c 中黑色沉淀部分变为红褐色。
(1)①同学甲认为实验a 中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是_____ 。
②同学乙认为实验b的黑色沉淀物中有FeS,则一定混有S,理由是_____ 。
③设计实验检验b的黑色沉淀物中混有硫。
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。

实验证明了b中黑色沉淀混有S,试剂a是_____ ,观察到的现象为________ 。
II.探究实验a中Fe3+与S2-没有发生氧化还原反应的原因经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨
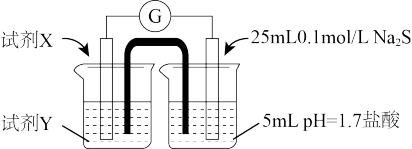
(2)①试剂X和Y分别是__________ 、_______ 。
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由_____ 。
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是_____ 。
④由此得出的实验结论是_____ 。
III.探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
(3)①用离子方程式解释实验1中的现象_____ 、_____ (写离子方程式)。
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因_____ 。
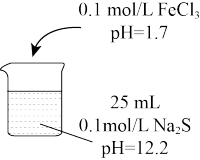 | 实验 a | 实验 b | 实验 c | |
| FeCl3体积 | 5 mL | 10 mL | 30 mL | |
| 实验现象 | 产生黑色浑浊,混合液pH=11.7 | 黑色浑浊度增大,混合液 pH=6.8 | 黑色浑浊比实验b明显减少,观察到大量黄色浑浊物,混合液 pH=3.7 |
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3。
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。b、c 中黑色沉淀部分变为红褐色。
(1)①同学甲认为实验a 中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是
②同学乙认为实验b的黑色沉淀物中有FeS,则一定混有S,理由是
③设计实验检验b的黑色沉淀物中混有硫。
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。

实验证明了b中黑色沉淀混有S,试剂a是
II.探究实验a中Fe3+与S2-没有发生氧化还原反应的原因经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨

(2)①试剂X和Y分别是
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是
④由此得出的实验结论是
III.探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
| 实验 1 | 实验 2 |
 固体溶解,闻到微量臭鸡蛋气味,溶液出现淡黄色浑浊。 |  |
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因
您最近一年使用:0次
2020-12-26更新
|
502次组卷
|
3卷引用:【区级联考】北京市丰台区2019届高三第二学期综合练习(一)(一模)化学试题
9 . 氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO 和Cl-。研究小组用如科实验装置(部分夹持装置略去)制取氯酸钾(KClO3),并测定其纯度。
和Cl-。研究小组用如科实验装置(部分夹持装置略去)制取氯酸钾(KClO3),并测定其纯度。
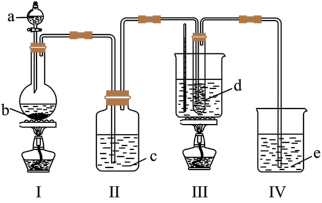
a为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质除KOH外还有___ 和___ 。
(2)已知碱性条件下,ClO-有强氧化性。设计实验证明“碱性条件下,H2O2能够被ClO-氧化”:___ 。
(必须选择的试剂和药品有:次氯酸钠溶液,H2O2溶液,NaOH溶液,木条。请写出实验操作及现象)。
(3)已知碱性条件下,ClO3-氧化性较弱,不能氧化H2O2。为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分反应,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(发生的反应为:ClO +I-+H+—Cl-+I2+H2O未配平)
+I-+H+—Cl-+I2+H2O未配平)
步骤4:加入指示剂,用0.5000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)
①步骤2中如果不进行煮沸所测定的KClO3纯度___ (填偏高、偏低或无影响)。
②样品中KClO3的质量分数为___ 。(KClO3相对分子质量:122.5)写出计算过程。
 和Cl-。研究小组用如科实验装置(部分夹持装置略去)制取氯酸钾(KClO3),并测定其纯度。
和Cl-。研究小组用如科实验装置(部分夹持装置略去)制取氯酸钾(KClO3),并测定其纯度。
a为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质除KOH外还有
(2)已知碱性条件下,ClO-有强氧化性。设计实验证明“碱性条件下,H2O2能够被ClO-氧化”:
(必须选择的试剂和药品有:次氯酸钠溶液,H2O2溶液,NaOH溶液,木条。请写出实验操作及现象)。
(3)已知碱性条件下,ClO3-氧化性较弱,不能氧化H2O2。为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分反应,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(发生的反应为:ClO
 +I-+H+—Cl-+I2+H2O未配平)
+I-+H+—Cl-+I2+H2O未配平)步骤4:加入指示剂,用0.5000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O
 +I2=S4O
+I2=S4O +2I-)
+2I-)①步骤2中如果不进行煮沸所测定的KClO3纯度
②样品中KClO3的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 铁是人类较早使用的金属之一,如图为铁及其化合物的“价—类”二维图。
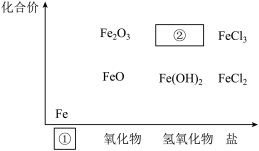
(1)填写二维图缺失的类别①___ 和化学式②___ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:①Cl2②Fe③NaOH④H2SO4⑤AgNO3。从物质类别上看,FeCl3属于___ ,可能与___ 发生反应(填序号);从化合价角度看,Fe3+具有___ 性,可能与___ 发生反应(填序号)。
(3)下列含铁元素物质既有氧化性又有还原性的是___ (用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(4)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是___ 。
(5)检验溶液中存在Fe3+的试剂是___ ,证明Fe3+存在的现象是___ 。

(1)填写二维图缺失的类别①
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:①Cl2②Fe③NaOH④H2SO4⑤AgNO3。从物质类别上看,FeCl3属于
(3)下列含铁元素物质既有氧化性又有还原性的是
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(4)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(5)检验溶液中存在Fe3+的试剂是
您最近一年使用:0次
2020-12-07更新
|
329次组卷
|
2卷引用:福建省三明市泰宁县福建省泰宁第一中学2019-2020学年高一上学期第二次阶段考试化学试题



