名校
解题方法
1 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
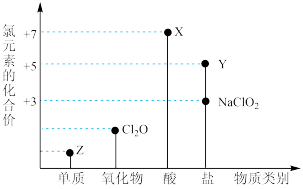
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___ 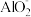 +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+ 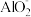 +
+
您最近一年使用:0次
2020-06-15更新
|
101次组卷
|
2卷引用:江西省南昌市八一中学2019-2020学年高一下学期期中考试化学试题
解题方法
2 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中还原剂与氧化剂的物质的量之比为___ 。
(3)检验物质Y的方法是___ 。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为___ 。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___ (填代号)。
a.Na2S+S b.SO2+Na2SO4 c.Na2SO3+S d.Na2SO3+Na2SO4 e.SO2+ Na2S2+Na2CO3
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL0.05 mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2Cr2O7溶液恰好完全反应时,Cr元素在还原产物中的化合价为___ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中还原剂与氧化剂的物质的量之比为
(3)检验物质Y的方法是
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.SO2+Na2SO4 c.Na2SO3+S d.Na2SO3+Na2SO4 e.SO2+ Na2S2+Na2CO3
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL0.05 mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2Cr2O7溶液恰好完全反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系(图中X是H2S):
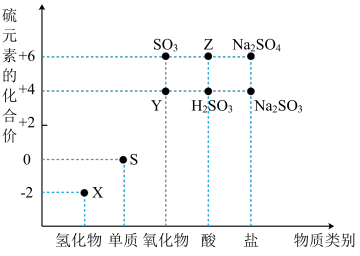
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有________ (填化学式);
(2)将X与Y混合,可生成S单质(淡黄色沉淀)。该反应的化学方程式为_______________ ,其中氧化产物与还原产物的物质的量之比为________ ;
(3)写出Z的稀溶液与Ba(OH)2溶液发生化学反应的离子方程式___________________________ ;
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是________ (填代号);
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05mol•L﹣1的Na2SO3溶液与 20mL 0.02mol•L﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成S单质(淡黄色沉淀)。该反应的化学方程式为
(3)写出Z的稀溶液与Ba(OH)2溶液发生化学反应的离子方程式
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05mol•L﹣1的Na2SO3溶液与 20mL 0.02mol•L﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
名校
解题方法
4 . 氧化性:Br2 > Fe3+> I2,向含 a mol FeI2和 a mol BaCl2的混合溶液中缓慢通入 b mol Br2,并不断搅拌,溶液中离子的物质的量随 Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化)。则下列说法不正确的是
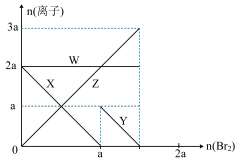

| A.离子的还原性 I-> Fe2+> Br- |
| B.四条线与溶液中离子的对应关系是: X-Fe2+、Y-I-、Z-Br-、W-Cl- |
| C.当4a =3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+):c(Br-) = 1:2:8 |
| D.当3a≤2b时,发生的离子方程式:2Fe2++ 4I-+ 3Br2=2Fe3++ 2I2+6Br- |
您最近一年使用:0次
2020-04-21更新
|
306次组卷
|
2卷引用:浙江省温州市龙湾中学2019-2020学年高二下学期第1次居家月考化学试题
名校
解题方法
5 . 利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______ (填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________ 。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl−和NO3-,其离子方程式为______________________________________ 。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________ 。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________ 。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________ 。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为
(4)W的稀溶液与铜单质发生反应的离子方程式为
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为
您最近一年使用:0次
2020-01-09更新
|
470次组卷
|
6卷引用:山东省济南中学2019-2020学年上学期高一选科调研化学试题
6 . 某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
(1)实验Ⅳ的作用是______________ 。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________ 。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。
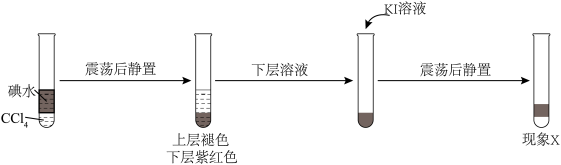
现象x是______________ 。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________ 。
假设2:O2只氧化了SO2,化学方程式是______________ 。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
结合化学反应,解释上表中的现象:______________ 。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________ 。
| 实验 | 气体a | 编号及现象 |
 | HCl | Ⅰ.溶液迅速呈黄色 |
| SO2 | Ⅱ.溶液较快呈亮黄色 | |
| CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
| 空气 | Ⅳ.长时间后,溶液无明显变化 |
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。

现象x是
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是
假设2:O2只氧化了SO2,化学方程式是
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
| 电解时间/min | 溶液 | 阳极 | 阴极 |
| t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
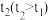 | 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
(6)综合实验证据说明影响I-被氧化的因素及对应关系
您最近一年使用:0次
2019-12-21更新
|
331次组卷
|
2卷引用:北京市第四中学2020届高三上学期期中考试化学试题
名校
7 . 下表中“试剂”与“操作及现象”对应关系错误的是
| 选项 | 试剂 | 操作及现象 |
| A | AgNO3溶液 | 滴加氨水,产生沉淀;继续滴加氨水,沉淀溶解 |
| B | 铝粉 | 滴加NaOH溶液,产生气体;继续滴加,产生白色沉淀 |
| C | CuSO4溶液 | 加过量NaOH溶液,产生蓝色沉淀;再加乙醛,加热,产生红色沉淀 |
| D | 氯水 | 滴加NaOH溶液,溶液颜色褪去;再加HCl,溶液颜色恢复 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-10-25更新
|
279次组卷
|
3卷引用:北京市第十中学2019届高三第一学期10月月考化学试题
名校
8 . 向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是
A.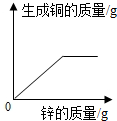 | B. | C.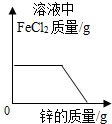 | D. |
您最近一年使用:0次
2016-12-09更新
|
278次组卷
|
6卷引用:2016-2017学年安徽省六安一中高一上开学测化学试卷
9 . 下列有关实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol·L-1 硫酸溶液 | 试管口出现红棕色气体 | 溶液中NO3- 被Fe2+还原为NO2 |
| B | H2S通入CuSO4溶液中 | 溶液中出现黑色沉淀 | 酸性:H2S>H2SO4溶液 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡、静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| D | 将一小块钠投入到CuSO4溶液中 | 有无色无味的气体放出,且出现蓝色沉淀 | 氧化性:H+>Cu2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . Cl2是一种重要的化工原料,在生产、生活和工业上均有很多用途。
(1)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为_____________
(2)可用于工业上制得高锰酸钾(KMnO4).其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分培烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2溶液变为紫红色,同时生成黑色固体。
IV.过滤,将紫红色溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得KMnO4固体。
资料:
KMnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是________________
②Ⅱ中,生成K2MnO4的化学方程式为____________
③Ⅲ中,CO2 和K2MnO4在溶液中反应的离子方程式是:_____________________
(未配平),氧化产物和还原产物的物质的量之比为______
(1)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为
(2)可用于工业上制得高锰酸钾(KMnO4).其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分培烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2溶液变为紫红色,同时生成黑色固体。
IV.过滤,将紫红色溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得KMnO4固体。
资料:
KMnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是
②Ⅱ中,生成K2MnO4的化学方程式为
③Ⅲ中,CO2 和K2MnO4在溶液中反应的离子方程式是:
(未配平),氧化产物和还原产物的物质的量之比为
您最近一年使用:0次



