名校
解题方法
1 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
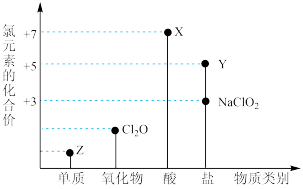
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___  +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+  +
+
您最近一年使用:0次
2020-06-15更新
|
102次组卷
|
2卷引用:江西省南昌市八一中学2019-2020学年高一下学期期中考试化学试题
2 . 某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
(1)实验Ⅳ的作用是______________ 。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________ 。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。
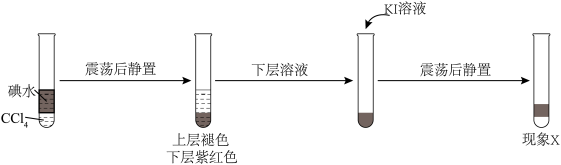
现象x是______________ 。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________ 。
假设2:O2只氧化了SO2,化学方程式是______________ 。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
结合化学反应,解释上表中的现象:______________ 。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________ 。
| 实验 | 气体a | 编号及现象 |
 | HCl | Ⅰ.溶液迅速呈黄色 |
| SO2 | Ⅱ.溶液较快呈亮黄色 | |
| CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
| 空气 | Ⅳ.长时间后,溶液无明显变化 |
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。

现象x是
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是
假设2:O2只氧化了SO2,化学方程式是
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
| 电解时间/min | 溶液 | 阳极 | 阴极 |
| t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
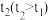 | 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
(6)综合实验证据说明影响I-被氧化的因素及对应关系
您最近一年使用:0次
2019-12-21更新
|
337次组卷
|
2卷引用:北京市第四中学2020届高三上学期期中考试化学试题
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系(图中X是H2S):
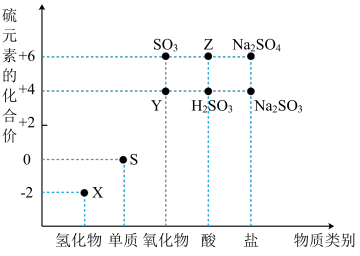
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有________ (填化学式);
(2)将X与Y混合,可生成S单质(淡黄色沉淀)。该反应的化学方程式为_______________ ,其中氧化产物与还原产物的物质的量之比为________ ;
(3)写出Z的稀溶液与Ba(OH)2溶液发生化学反应的离子方程式___________________________ ;
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是________ (填代号);
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05mol•L﹣1的Na2SO3溶液与 20mL 0.02mol•L﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成S单质(淡黄色沉淀)。该反应的化学方程式为
(3)写出Z的稀溶液与Ba(OH)2溶液发生化学反应的离子方程式
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05mol•L﹣1的Na2SO3溶液与 20mL 0.02mol•L﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
名校
解题方法
4 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是___________ ,具有___________ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作___________ (填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:___________ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为___________ 。
②装置C中观察到的现象是___________ ,反应的化学方程式是___________ 。
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是___________ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作
反应过程中氧化产物与还原产物的个数比为:
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为
②装置C中观察到的现象是
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是
您最近一年使用:0次
2021-03-21更新
|
588次组卷
|
4卷引用:重庆市南坪中学2020-2021学年高一上学期期中考试化学试题
重庆市南坪中学2020-2021学年高一上学期期中考试化学试题广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
5 . 四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2 +O2+xOH-=Fe3O4↓+
+O2+xOH-=Fe3O4↓+ +2H2O。下列问题叙述不正确的是( )
+2H2O。下列问题叙述不正确的是( )
 +O2+xOH-=Fe3O4↓+
+O2+xOH-=Fe3O4↓+ +2H2O。下列问题叙述不正确的是( )
+2H2O。下列问题叙述不正确的是( )A.水热法制备Fe3O4纳米颗粒的反应中,还原剂是 |
| B.反应的离子方程式中x=4 |
| C.每生成1molFe3O4,反应转移的电子为4mol |
| D.被Fe2+还原的O2的物质的量为0.5mol |
您最近一年使用:0次
2020-11-15更新
|
301次组卷
|
2卷引用:黑龙江省哈尔滨市第一中学2021届高三上学期期中考试化学试题
名校
6 . Cl2是一种重整的化工原料,在生产、生活和工业上均有很多用途。
(1)可与氢气化合制得盐酸。化学方程式为________________ 。
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为_______________ 。
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为_______________ 。其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是_____________ 。
②Ⅰ中,生成K2MnO4的化学方程式是____________ 。
③Ⅱ中,浸取时用稀KOH溶液的原因是_____________ 。
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为____________ 。
(1)可与氢气化合制得盐酸。化学方程式为
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是
②Ⅰ中,生成K2MnO4的化学方程式是
③Ⅱ中,浸取时用稀KOH溶液的原因是
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO
 +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为
您最近一年使用:0次
14-15高三上·四川成都·阶段练习
名校
7 . 四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具 水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓ + S4O62- + 2H2O 。下列说法不正确的是
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓ + S4O62- + 2H2O 。下列说法不正确的是

 水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓ + S4O62- + 2H2O 。下列说法不正确的是
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓ + S4O62- + 2H2O 。下列说法不正确的是

| A.参加反应的氧化剂与还原剂的物质的量之比为1:5 |
| B.若有2molFe2+ 被氧化,则被Fe2+还原的O2的物质的量为0.5 mol |
| C.每生成1 molFe3O4 ,反应转移的电子为4 mol |
| D.O2是氧化剂,S2O32-与Fe2+是还原剂 |
您最近一年使用:0次
2019-12-16更新
|
347次组卷
|
10卷引用:【全国百强校】辽宁省实验中学2018-2019学年高一(实验班)上学期期中考试化学试题
【全国百强校】辽宁省实验中学2018-2019学年高一(实验班)上学期期中考试化学试题(已下线)2014-2015学年四川邛崃市高埂中学高三上学期第一次月考化学试卷2016届陕西省西安铁一中高三上12月模拟化学试卷【全国百强校】辽宁省沈阳市东北育才学校2019届高三上学期联合考试化学试题上海市复旦中学2019-2020学年高二上学期第一次月考化学试题陕西省西安中学2020届高三上学期第三次月考化学试题2019年秋高三化学复习强化练习—— 氧化还原反应(强化练)湖北省荆州市荆州中学2019-2020学年高一下学期3月月考化学试题山西省实验中学2019届高三上学期第四次月考化学试题黑龙江省鹤岗市第一中学2022-2023学年高三上学期开学考试化学试题
名校
8 . 氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________ ,还原产物是____________ 。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________ 价。
②以上反应中的氧化剂为________ ,当有1 mol CuI参与反应时,转移电子________ mol。
③标明上述反应电子转移的方向和数目。____________________________ 。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______ ,MnO4-+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显
②以上反应中的氧化剂为
③标明上述反应电子转移的方向和数目。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为
您最近一年使用:0次
2019-01-03更新
|
394次组卷
|
11卷引用:贵州省正安县一中2018-2019学年高一上学期期中考试化学试题
贵州省正安县一中2018-2019学年高一上学期期中考试化学试题云南省玉溪市新平彝族傣族自治县第三中学2019-2020学年高一上学期期中考试化学试题云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题安徽省定远重点中学2018-2019学年高一下学期开学考试化学试题云南省广南二中2018-2019学年高一6月份考试化学试题云南省景谷一中2018-2019学年高一下学期期末考试化学试题云南省澜沧县民中2018-2019学年高一下学期期末考试化学试题云南省保山市昌宁县二中2019-2020学年高一10月月考化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷四川省泸州市泸县第二中学2019-2020学年高一下学期第一次在线月考化学试题安徽省滁州市定远县重点中学2020-2021学年高一10月月考化学试题
名校
9 . K2FeO4可用作水处理剂,它可由3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O制得。下列说法不正确的是
| A.Cl2是氧化剂,Fe(OH)3在反应中失去电子 |
| B.氧化性:Fe(OH)3 >K2FeO4 |
| C.每生成l mol氧化产物转移的电子的物质的量为3 mol |
| D.K2 FeO4的用途与胶体和氧化剂知识有关 |
您最近一年使用:0次
2018-09-29更新
|
147次组卷
|
3卷引用:河北省承德一中2019届高三上学期第二次月考(期中)化学试题
名校
解题方法
10 . 元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________ 。
a.简单离子的半径先减小后增大,卤素离子半径最大
b.元素金属性减弱,非金属性增强
c.最高价氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点逐渐降低
(2)原子最外层电子数是次外层电子数一半的元素名称为____ ,还原性最弱的简单阴离子是____ 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是________________________________ ,根据熔点推测Al2O3是___________ 化合物。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:_____________ ,在上述由SiCl4(g)制纯硅的反应中,测得每生成0.56 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:_____________________________________________ 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,但可用P2O5干燥的是_________ 。
a.HI b.NH3 c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:_______________________________ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.简单离子的半径先减小后增大,卤素离子半径最大
b.元素金属性减弱,非金属性增强
c.最高价氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点逐渐降低
(2)原子最外层电子数是次外层电子数一半的元素名称为
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 共价化合物 | |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)
 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)写出SiCl4的电子式:
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,但可用P2O5干燥的是
a.HI b.NH3 c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
您最近一年使用:0次



