安徽省滁州市明光市第二中学2020-2021学年高二下学期期末评价性考试化学试题
安徽
高二
期末
2021-08-20
284次
整体难度:
容易
考查范围:
化学反应原理、认识化学科学、有机化学基础、常见无机物及其应用、化学实验基础
安徽省滁州市明光市第二中学2020-2021学年高二下学期期末评价性考试化学试题
安徽
高二
期末
2021-08-20
284次
整体难度:
容易
考查范围:
化学反应原理、认识化学科学、有机化学基础、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 二氧化碳加氢合成乙烯是综合利用CO2的热点研究领域。其原理为2CO2(g)+6H2(g) C2H4(g)+4H2O(g),在反应进程中采取下列措施,可以降低反应速率的是
C2H4(g)+4H2O(g),在反应进程中采取下列措施,可以降低反应速率的是
 C2H4(g)+4H2O(g),在反应进程中采取下列措施,可以降低反应速率的是
C2H4(g)+4H2O(g),在反应进程中采取下列措施,可以降低反应速率的是| A.降温 | B.加入催化剂 | C.缩小反应器体积 | D.体积不变,加入CO2 |
您最近一年使用:0次
2021-08-19更新
|
282次组卷
|
4卷引用:安徽省滁州市明光市第二中学2020-2021学年高二下学期期末评价性考试化学试题
安徽省滁州市明光市第二中学2020-2021学年高二下学期期末评价性考试化学试题(已下线)2.1.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖南省邵阳市文德高级中学2021-2022学年高二上学期第一次月考化学试题内蒙古阿拉善盟第一中学2022-2023学年高二上学期期末考试化学试题
单选题
|
容易(0.94)
名校
2. 下列有关说法正确的是
A.丙烷的比例模型为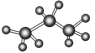 | B.丙烯的结构简式为CH3CHCH2 |
C.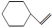 的分子式为C8H14 的分子式为C8H14 | D.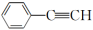 与C8H6一定是同一种物质 与C8H6一定是同一种物质 |
您最近一年使用:0次
2021-08-19更新
|
394次组卷
|
5卷引用:安徽省滁州市明光市第二中学2020-2021学年高二下学期期末评价性考试化学试题
单选题
|
适中(0.65)
名校
3. 煤的气化原理为C(s)+H2O(g)⇌CO(g)+H2(g),在某恒温恒容反应器中模拟该反应,不能作为达到平衡状态的标志为
| A.压强不变 | B.v(H2O)正=v(CO)正 |
| C.混合气体的密度不变 | D.CO的体积分数不变 |
【知识点】 化学平衡状态 化学平衡的移动及其影响因素
您最近一年使用:0次
2021-03-20更新
|
216次组卷
|
3卷引用:安徽省江淮名校2020-2021学年高二下学期开学联考化学试题
单选题
|
较易(0.85)
名校
解题方法
4. 下列有机分子中,所有原子不可能处于同一平面的是
A. | B. |
C.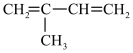 | D.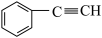 |
【知识点】 有机分子中原子共面的判断解读
您最近一年使用:0次
2021-07-22更新
|
156次组卷
|
6卷引用:青海省西宁市大通回族土族自治县2020-2021学年高二下学期期末联考化学试题
单选题
|
较易(0.85)
名校
5. 下列有机物用系统命名法命名正确的是
A.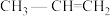 2-甲基丙烯 2-甲基丙烯 |
B.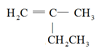 2-甲基-1-丁烯 2-甲基-1-丁烯 |
C. 1-羟基丁烷 1-羟基丁烷 |
D.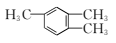 1,3,4-三甲苯 1,3,4-三甲苯 |
【知识点】 醇的命名 烯烃系统命名法解读 含有苯环的化合物的命名解读
您最近一年使用:0次
2021-07-22更新
|
233次组卷
|
4卷引用:青海省西宁市大通回族土族自治县2020-2021学年高二下学期期末联考化学试题
单选题
|
适中(0.65)
名校
6. 锌猛干电池是日常生活中常用的一次电池。一种处理废旧干电池的流程如下:
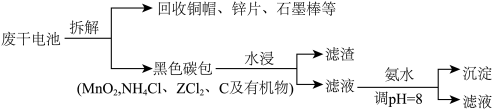
下列叙述错误的是

下列叙述错误的是
| A.合理处理废旧电池有利于保护环境和资源再利用 |
| B.“水浸”后的滤渣干燥后经充分灼烧可回收其中的MnO2 |
| C.“沉淀”反应后的滤液可通过蒸发至干回收NH4Cl |
| D.“沉淀”反应的离子方程式为:Zn2+ + 2NH3·H2O = Zn(OH)2↓ + 2NH4+ |
您最近一年使用:0次
2019-06-26更新
|
271次组卷
|
2卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期第三次月考化学试题
单选题
|
适中(0.65)
名校
7. 丙烯与HCl加成可能发生反应①和②,其能量与反应进程如图所示:下列说法正确的是
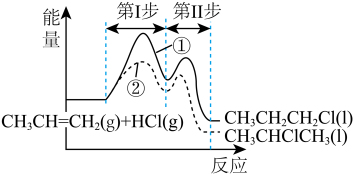

| A.CH3CHClCH3比 CH3CH2CH2Cl 稳定 |
| B.反应①的第I步与第Ⅱ步均放出能量 |
| C.反应②的第I步比第Ⅱ步反应速率快 |
| D.活化能反应①比②的大,反应①更易进行 |
您最近一年使用:0次
2019-06-26更新
|
407次组卷
|
3卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期第三次月考化学试题
单选题
|
较易(0.85)
名校
8. 下列有关说法正确的是
| A.直径为2.5μm的颗粒在空气中形成气溶胶 |
| B.用可见光束照射可区别溶液和胶体 |
| C.氨水可以导电,说明NH3是电解质 |
| D.氧化还原反应都是放热反应 |
您最近一年使用:0次
2019-05-06更新
|
136次组卷
|
3卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
9. 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 移取15.00 mLKI溶液 | 向20 mL量筒加入KI溶液至刻度线15处,然后倒出 |
| B | 制取并纯化SO2 | 将浓硫酸滴入Na2SO3中,生成的气体依次通过饱和NaHCO3溶液、浓硫酸 |
| C | 比较BaSO4和BaSO3的Ksp | 向盛有BaCl2溶液的试管中先加入Na2SO3溶液,然后加入Na2SO4,观察现象 |
| D | 探究H2O2的还原性 | 向盛有2mL酸性KMnO4溶液的试管中滴加浓的H2O2溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-05-06更新
|
213次组卷
|
3卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
10. 苹果酸为二元有机弱酸( )。下列关于
)。下列关于 及
及 叙述正确的是
叙述正确的是
 )。下列关于
)。下列关于 及
及 叙述正确的是
叙述正确的是A.电离方程式: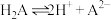 | B. 溶液中含有2种分子: 溶液中含有2种分子: 与 与 |
C. 溶液: 溶液: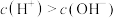 | D. 溶液: 溶液: |
【知识点】 电离方程式解读 弱电解质的电离平衡 盐溶液中离子浓度大小的比较解读
您最近一年使用:0次
2022-04-04更新
|
236次组卷
|
5卷引用:安徽省江淮名校2020-2021学年高二下学期开学联考化学试题
单选题
|
较易(0.85)
解题方法
11. 一种合成Barrelene(桶烯)的部分流程如图。
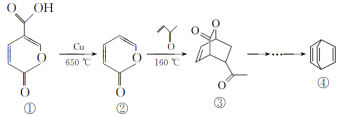
下列说法错误的是

下列说法错误的是
| A.④与苯乙烯互为同分异构体 | B.④的二氯代物有4种 |
| C.②生成③反应属于加成反应 | D.①②③均能与NaOH反应 |
您最近一年使用:0次
单选题
|
较易(0.85)
12. 薄荷醇和异戊酸在一定条件下可合成香精异戊酸薄荷酯,其结构简式如图。下列说法中正确的是


| A.异戊酸的酯类异构体有9种(不考虑立体异构) |
| B.薄荷醇与乙醇互为同系物 |
| C.异戊酸薄荷酯的分子式为C15H26O2 |
| D.异戊酸薄荷酯在酸性环境中不能发生取代反应 |
您最近一年使用:0次
13. 钒液流二次电池被公认为最具前景的大规模储能技术之一。某钒液流电池放电时结构如图所示,酸性环境中其反应原理为:2VCl2+BrCl
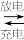 2VCl3+Br-。
2VCl3+Br-。
下列说法中正确的是

 2VCl3+Br-。
2VCl3+Br-。
下列说法中正确的是
| A.正极储液罐中含有VCl2 |
| B.放电时电流由电极N经负载流向电极M |
| C.充电时电极N与直流电源正极相连 |
D.充电时电极M上的反应式为Br-+2Cl-−2e-=BrCl |
您最近一年使用:0次
2021-08-19更新
|
148次组卷
|
2卷引用:安徽省滁州市明光市第二中学2020-2021学年高二下学期期末评价性考试化学试题
单选题
|
适中(0.65)
解题方法
14. 25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HR溶液,溶液的AG值[AG=lg ]随NaOH溶液体积变化如图所示。
]随NaOH溶液体积变化如图所示。
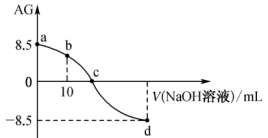
下列说法中正确的是
 ]随NaOH溶液体积变化如图所示。
]随NaOH溶液体积变化如图所示。
下列说法中正确的是
| A.a点所示溶液的pH=3.75,HR是弱酸 |
| B.b点所示的溶液中c(R-)+2c(OH-)=c(HR)+2c(H+) |
| C.c点加入NaOH溶液为20mL |
| D.d点所示的溶液中c(R-)>c(Na+) |
您最近一年使用:0次
2021-08-19更新
|
275次组卷
|
3卷引用:安徽省滁州市明光市第二中学2020-2021学年高二下学期期末评价性考试化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
15. “结晶玫瑰”的化学名称为乙酸三氯甲基苯甲酯,相对分子质量为267.5;白色至微黄色晶体;熔点为88℃;不溶于水,溶于乙醇,70℃时在乙醇中溶解度为ag,25℃时在乙醇中溶解度为0.2ag。通常用三氯甲基苯基甲醇和醋酸酐为原料制备,其反应方程式为:

已知:
I.三氯甲基苯基甲醇,相对分子质量为224.5;无色液体;不溶于水,溶于乙醇。
II.醋酸酐,无色液体;溶于水形成乙酸,溶于乙醇。操作步骤如下: 粗产品
粗产品
回答下列问题:
(1)加料时,应先加入___ ,然后慢慢加入___ 并搅拌。待混合均匀后,宜采用油浴加热而不采用水浴加热的原因是___ 。
(2)粗产品的成分是结晶玫瑰与少量三氯甲基苯基甲醇的混合物,现设计如下方案进行提纯。请将实验步骤补充完整:
①将粗产品溶解在___ (填“水”或“乙醇”)中,用水浴加热到___ ,回流溶剂使粗产品充分溶解,得到无色溶液。
②将步骤①所得溶液___ ,析出白色晶体。
③将步骤②所得混合物___ 、干燥晶体,得到白色晶体。
(3)45.1g三氯甲基苯基甲醇与足量醋酸酐充分反应得到结晶玫瑰45.5g,则产率是___ (保留三位有效数字)。

已知:
I.三氯甲基苯基甲醇,相对分子质量为224.5;无色液体;不溶于水,溶于乙醇。
II.醋酸酐,无色液体;溶于水形成乙酸,溶于乙醇。操作步骤如下:
 粗产品
粗产品回答下列问题:
(1)加料时,应先加入
(2)粗产品的成分是结晶玫瑰与少量三氯甲基苯基甲醇的混合物,现设计如下方案进行提纯。请将实验步骤补充完整:
①将粗产品溶解在
②将步骤①所得溶液
③将步骤②所得混合物
(3)45.1g三氯甲基苯基甲醇与足量醋酸酐充分反应得到结晶玫瑰45.5g,则产率是
【知识点】 物质含量的测定
您最近一年使用:0次
16. 哈伯的合成氨反应开创了人工固氮的先河,为解决人类的粮食危机做出了重大贡献。回答下列问题:
(1)对于合成氨反应:N2(g)+3H2(g) 2NH3(g),已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是945.6kJ·mol-1,则上述反应的△H=
2NH3(g),已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是945.6kJ·mol-1,则上述反应的△H=___ 。
(2)在500℃时,分别将2molN2和6molH2充入一个容积为1L的恒容密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
①10min内H2的平均反应速率为___ ,达平衡状态时,N2的转化率为___ ,平衡常数K为___ (保留两位小数)。
②相同温度下,若向相同容积的另一容器中投入N2、H2、NH3各2mol,此时υ正___ (填“>”“<”或“=”)υ逆。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1molN2和3molH2组成的混合气体,发生反应N2(g)+3H2(g) 2NH3(g),平衡后改变容器体积,容器内N2的体积分数随压强的变化如图所示。
2NH3(g),平衡后改变容器体积,容器内N2的体积分数随压强的变化如图所示。

①根据题中信息可得:温度T1___ (填“>”或“<”)T2。
②B、C两点的平衡常数大小关系为KB___ (填“>”“<”或=”,下同)KC。
③A点和B点混合气体的密度大小关系:ρA___ ρB。
(1)对于合成氨反应:N2(g)+3H2(g)
 2NH3(g),已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是945.6kJ·mol-1,则上述反应的△H=
2NH3(g),已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是945.6kJ·mol-1,则上述反应的△H=(2)在500℃时,分别将2molN2和6molH2充入一个容积为1L的恒容密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②相同温度下,若向相同容积的另一容器中投入N2、H2、NH3各2mol,此时υ正
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1molN2和3molH2组成的混合气体,发生反应N2(g)+3H2(g)
 2NH3(g),平衡后改变容器体积,容器内N2的体积分数随压强的变化如图所示。
2NH3(g),平衡后改变容器体积,容器内N2的体积分数随压强的变化如图所示。
①根据题中信息可得:温度T1
②B、C两点的平衡常数大小关系为KB
③A点和B点混合气体的密度大小关系:ρA
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
17. 利用石灰石(主要成分为CaCO3)和软锰矿浆(主要成分为MnO2,还含有少量的铁、铝等化合物)处理硫酸工业的尾气(主要成分为SO2)制备Mn3O4和(NH4)2SO4的工艺流程如图所示:

回答下列问题:
(1)将石灰石粉碎成粉末状的优点是___ (写出一点)。
(2)通过“反应1”可将尾气中的SO2转化为CaSO4,写出反应的化学方程式:___ 。
(3)“反应2”中温度需要控制在50℃,温度不宜过高的主要原因是___ 。
(4)“MnSO4浸出液”中加入MnCO3可将Fe3+和Al3+分别转化沉淀而除去,写出除去Fe3+反应的离子方程式:___ ,为了使溶液中Al3+和Fe3+的浓度均小于3×10-6mol·L-1,则溶液的pH应不小于___ {Ksp[Al(OH)3]=3×10-33,Ksp[Fe(OH)3]=4×10-38}。
(5)Mn3O4中+2价锰元素和+3价锰元素的个数比为___ ,Mn3O4与盐酸反应可生成氯气,每生成2molCl2,理论上消耗Mn3O4的物质的量为___ 。

回答下列问题:
(1)将石灰石粉碎成粉末状的优点是
(2)通过“反应1”可将尾气中的SO2转化为CaSO4,写出反应的化学方程式:
(3)“反应2”中温度需要控制在50℃,温度不宜过高的主要原因是
(4)“MnSO4浸出液”中加入MnCO3可将Fe3+和Al3+分别转化沉淀而除去,写出除去Fe3+反应的离子方程式:
(5)Mn3O4中+2价锰元素和+3价锰元素的个数比为
您最近一年使用:0次
解答题-有机推断题
|
较易(0.85)
18. 有机化合物K( )是某抗肿瘤药物的中间体,其合成流程如图所示(部分反应条件已略去):
)是某抗肿瘤药物的中间体,其合成流程如图所示(部分反应条件已略去):
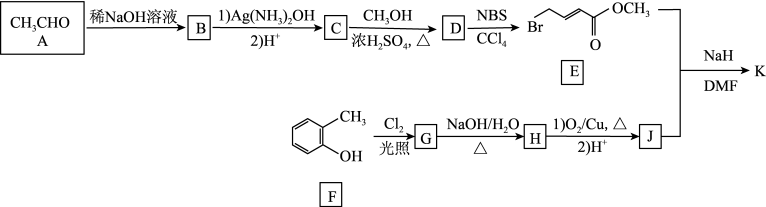
已知:RCHO+CH3CHO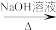 RCH=CHCHO+H2O
RCH=CHCHO+H2O
回答下列问题:
(1)F的名称为___ 。
(2)K中含氧官能团的名称为___ 。
(3)D的结构简式为___ ,由D生成E的反应类型为___ 。
(4)E与NaOH溶液反应的化学方程式为___ 。
(5)R与J互为同分异构体,R中除苯环外没有其他环状结构,其核磁共振氢谱中有四组峰,写出符合条件的R的结构简式:___ 。
(6)写出以苯甲醇和乙醛为初始原料合成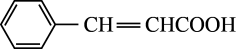 的路线(其他试剂任选)
的路线(其他试剂任选)___ 。
 )是某抗肿瘤药物的中间体,其合成流程如图所示(部分反应条件已略去):
)是某抗肿瘤药物的中间体,其合成流程如图所示(部分反应条件已略去):
已知:RCHO+CH3CHO
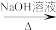 RCH=CHCHO+H2O
RCH=CHCHO+H2O回答下列问题:
(1)F的名称为
(2)K中含氧官能团的名称为
(3)D的结构简式为
(4)E与NaOH溶液反应的化学方程式为
(5)R与J互为同分异构体,R中除苯环外没有其他环状结构,其核磁共振氢谱中有四组峰,写出符合条件的R的结构简式:
(6)写出以苯甲醇和乙醛为初始原料合成
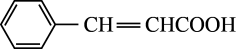 的路线(其他试剂任选)
的路线(其他试剂任选)
您最近一年使用:0次
试卷分析
导出
整体难度:适中
考查范围:化学反应原理、认识化学科学、有机化学基础、常见无机物及其应用、化学实验基础
试卷题型(共 18题)
题型
数量
单选题
14
解答题
4
试卷难度
知识点分析
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 影响化学反应速率的外因 浓度对化学反应速率的影响 温度对化学反应速率的影响 催化剂对化学反应速率的影响 | |
| 2 | 0.94 | 有关粒子结构的化学用语 结构式、结构简式、比例模型、球棍模型、最简式 同分异构现象、同分异构体的概念 | |
| 3 | 0.65 | 化学平衡状态 化学平衡的移动及其影响因素 | |
| 4 | 0.85 | 有机分子中原子共面的判断 | |
| 5 | 0.85 | 醇的命名 烯烃系统命名法 含有苯环的化合物的命名 | |
| 6 | 0.65 | 铵盐的不稳定性 废弃电池的污染及回收 物质分离、提纯的常见物理方法 物质分离、提纯综合应用 | |
| 7 | 0.65 | 焓变 化学能与物质稳定性之间的关系 吸热反应和放热反应 活化能及其对反应速率的影响 | |
| 8 | 0.85 | 胶体的定义及分类 胶体的性质和应用 非电解质、电解质物质类别判断 氧化还原反应定义、本质及特征 | |
| 9 | 0.65 | 氧化还原反应的规律 二氧化硫的化学性质 溶度积规则及其应用 化学实验方案的设计与评价 | |
| 10 | 0.65 | 电离方程式 弱电解质的电离平衡 盐溶液中离子浓度大小的比较 | |
| 11 | 0.85 | “四同”的相关比较 同分异构体的数目的确定 加成反应 酯的水解反应机理 | |
| 12 | 0.85 | 有机官能团的性质及结构 同系物的判断 根据要求书写同分异构体 酯的水解反应机理 | |
| 13 | 0.65 | 原电池电子流向判断及应用 原电池正负极判断 原电池、电解池综合考查 电解池电极反应式及化学方程式的书写与判断 | |
| 14 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 15 | 0.65 | 物质含量的测定 | 实验探究题 |
| 16 | 0.85 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学平衡的有关计算 化学平衡图像分析 化学平衡常数的有关计算 | 原理综合题 |
| 17 | 0.65 | 氧化还原反应方程式的配平 含氧化铝的混合物的提纯 溶度积常数相关计算 常见无机物的制备 | 工业流程题 |
| 18 | 0.85 | 根据要求书写同分异构体 有机物的合成 有机物的推断 根据题给物质选择合适合成路线 | 有机推断题 |



