22-23高三上·山东潍坊·阶段练习
解题方法
1 . 某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i. 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被
可被 还原为
还原为 。
。
iii. 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
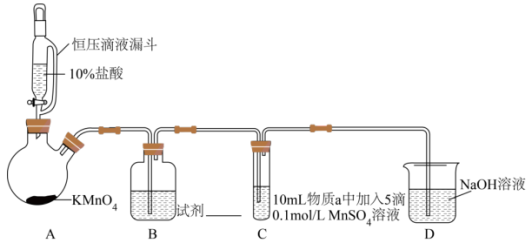
(1)通入 前,II、III中沉淀由白色变为黑色的化学方程式为
前,II、III中沉淀由白色变为黑色的化学方程式为_______ 。
(2)对比实验I、II通入 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是_______ 。
(3)根据资料ⅱ,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 发生反应
发生反应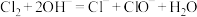 ,导致溶液的碱性减弱。但通过实验测定溶液的碱性变化很小。
,导致溶液的碱性减弱。但通过实验测定溶液的碱性变化很小。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_______ ,溶液绿色缓慢加深,原因是 被
被_______ (填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
②取II中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生的反应是_______ 。
③从反应速率的角度,分析实验III未得到绿色溶液的可能原因_______ 。
资料:i.
 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被
可被 还原为
还原为 。
。iii.
 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。实验装置如图(夹持装置略)

| 序号 | 物质a | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| III | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
 前,II、III中沉淀由白色变为黑色的化学方程式为
前,II、III中沉淀由白色变为黑色的化学方程式为(2)对比实验I、II通入
 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是(3)根据资料ⅱ,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 发生反应
发生反应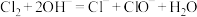 ,导致溶液的碱性减弱。但通过实验测定溶液的碱性变化很小。
,导致溶液的碱性减弱。但通过实验测定溶液的碱性变化很小。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
 被
被②取II中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生的反应是
③从反应速率的角度,分析实验III未得到绿色溶液的可能原因
您最近一年使用:0次
2 . 下图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。向 晶体滴加浓盐酸后,立即用另一培养皿扣在上面。已知:
晶体滴加浓盐酸后,立即用另一培养皿扣在上面。已知: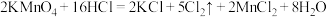 、
、 、
、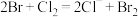 (溴单质为深红棕色)
(溴单质为深红棕色)

能全面解释实验现象且正确的是
 晶体滴加浓盐酸后,立即用另一培养皿扣在上面。已知:
晶体滴加浓盐酸后,立即用另一培养皿扣在上面。已知: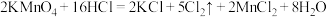 、
、 、
、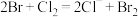 (溴单质为深红棕色)
(溴单质为深红棕色)
能全面解释实验现象且正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性: |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-18更新
|
1345次组卷
|
51卷引用:河南省南阳市2016-2017学年高一上学期期终质量评估化学试题
河南省南阳市2016-2017学年高一上学期期终质量评估化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题(已下线)2013-2014学年浙江省宁波市八校高一上学期期末联考化学试卷(已下线)2014高考化学专题突破训练 专题10非金属及其化合物练习卷(已下线)2014高考名师推荐化学氯、溴、碘及其化合物主要性质(已下线)2013-2014学年浙江省杭州地区六校高二下学期期中联考化学试卷(已下线)2013-2014河北省石家庄一中上学期开学考试高二化学试卷(已下线)2015届湖南省长沙市长郡中学高三第一次月考化学试卷2015届辽宁省抚顺市二中高三上学期期中考试化学试卷2014-2015河北唐山市一中高一下学期开学调研考试化学试卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年湖南省长沙市望城一中高一上期末化学试卷2016-2017学年江西省南昌市第二中学高一上学期期末考试化学试卷河北省涞水波峰中学2018届高三第一次调研考试化学试题甘肃省兰州市第一中学2018届高三8月月考化学试题天津市和平区2017-2018学年高一上学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氯及其化合物【押题专练】辽宁省阜新市海州高级中学2019届高三上学期第一次月考化学试题河北省承德市第一中学2018-2019学年高一上学期第三次月考化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期开学考试化学试题陕西省榆林市第二中学2018-2019学年高二下学期期中考试化学试题2019届上海奉贤区高考第一次模拟化学试题陕西省西安电子科技大学附属中学2019-2020学年高一上学期期末考试化学试题2020届上海市奉贤区高考化学一模试卷2012年上海市高考化学试题(已下线)【南昌新东方】师大附中2019-2020 高一(上) 期末安徽省肥东县第二中学2019-2020学年高一下学期期中考试(共建班)化学试题江西省奉新县第一中学2021届高三上学期第一次月考化学试题内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 教材帮江西省上饶市横峰中学2021届高三上学期第一次月考化学试题宁夏青铜峡市高级中学2021届高三上学期期中考试化学试题黑龙江伊春林业管理局第二中学2021届高三上学期期中考试化学试题(已下线)第12讲 富集在海水中的元素——卤素(精讲)-2022年一轮复习讲练测(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题浙江省绍兴市第一中学2016-2017学年高一下学期期末考试化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期11月测试化学试题浙江省宁波中学2021-2022学年高一上学期期中考试化学试题(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第12讲 富集在海水中的元素——卤素(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)天津市红桥区2019-2020学年高一上学期期末考试化学试题(已下线)2.2.2 氯气与金属、非金属及还原性化合物的反应-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题福建省龙岩第一中学2022-2023学年高一上学期第二次月考化学试题江西省景德镇一中2022-2023学年高一上学期期中(18班)化学试题.广东省广州市第八十六中学2022-2023学年高一上学期期中考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第二单元03巩固练
3 . 高铁酸钾 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中产生
溶液,具有强氧化性,在酸性或中性溶液中产生 ,在碱性溶液中较稳定.实验室用如图所示装置(夹持仪器已省略)制备
,在碱性溶液中较稳定.实验室用如图所示装置(夹持仪器已省略)制备 。
。

回答下列问题:
(1)仪器a的名称为_______ ,使用前需_______ 。
(2)装置A圆底烧瓶中发生反应的离子方程式为_______ 。
(3)装置B的作用是_______ 。
(4)装置C中发生反应的化学方程式为_______ ,该反应说明在此条件下 的氧化性比
的氧化性比
_______ (填“强”或“弱”),当装置C中得到大量紫色固体时立即停止通入 ,原因是
,原因是_______ 。
(5)装置D可用于吸收多余的 ,吸收液具有
,吸收液具有_______ (填字母)。
a.氧化性 b.还原性 c.漂白性
 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中产生
溶液,具有强氧化性,在酸性或中性溶液中产生 ,在碱性溶液中较稳定.实验室用如图所示装置(夹持仪器已省略)制备
,在碱性溶液中较稳定.实验室用如图所示装置(夹持仪器已省略)制备 。
。
回答下列问题:
(1)仪器a的名称为
(2)装置A圆底烧瓶中发生反应的离子方程式为
(3)装置B的作用是
(4)装置C中发生反应的化学方程式为
 的氧化性比
的氧化性比
 ,原因是
,原因是(5)装置D可用于吸收多余的
 ,吸收液具有
,吸收液具有a.氧化性 b.还原性 c.漂白性
您最近一年使用:0次
名校
4 . 下图为元素周期表的一部分 ,图中所列字母分别代表一种化学元素
(1)元素b、c、e形成的常见稳定单质中最易与H2化合的是_______ (填化学式)。
(2)元素d、e所形成的某化合物的摩尔质量为110 g·mol-1, 该化合物的化学式为_______ ,其中所含化学键的类型有_______ 。
(3)推测原子序数为35的元素在元素周期表中的位置是_______ 。
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是_______(填字母)。
(5)气体分子(ab)2中各原子最外层都达到8电子结构,该分子的电子式为_______ ,(ab)2称为拟卤素,性质与卤素单质相似,常温下其与NaOH溶液反应的化学方程式为_______ 。
| a | b | c | |||||||||||||||
| d | e | ||||||||||||||||
| …… | f | ||||||||||||||||
(2)元素d、e所形成的某化合物的摩尔质量为110 g·mol-1, 该化合物的化学式为
(3)推测原子序数为35的元素在元素周期表中的位置是
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是_______(填字母)。
| A.f的单质常温下呈气态 |
| B.f的单质具有强氧化性 |
| C.fc3属于酸性氧化物 |
| D.fc2既有氧化性又有还原性 |
您最近一年使用:0次
名校
5 . 某校化学实验兴趣小组为探究卤素单质性质进行了以下实验:
I.为验证卤族元素性质的递变规律,某同学设计了如图所示装置。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(1)A处反应的离子方程式:___________ ,B处的实验现象为___________ ,C处沾有NaOH溶液的棉花的作用为___________ ;
(2)该实验___________ 验证非金属性Cl>Br>I(填“能”或“不能”),理由是___________ ;
II.已知Cl2可以将Fe2+氧化成Fe3+,为探究Br2能否将Fe2+氧化成Fe3+,某同学甲做了以下实验:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后观察到溶液呈黄色。
(3)乙同学认为不能据此现象认为Br2氧化性比Fe3+强,理由是___________ ;
(4)丙同学选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了氧化性:Br2>Fe3+。请在表中写出丙同学可能选用的试剂及实验中观察到的现象(供选用的试剂:a.酚酞试液、b.CCl4、c.无水酒精、d.KSCN溶液)。
(5)向FeBr2溶液中通入少量Cl2,发生反应的离子方程式为___________ 。
I.为验证卤族元素性质的递变规律,某同学设计了如图所示装置。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(1)A处反应的离子方程式:
(2)该实验
II.已知Cl2可以将Fe2+氧化成Fe3+,为探究Br2能否将Fe2+氧化成Fe3+,某同学甲做了以下实验:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后观察到溶液呈黄色。
(3)乙同学认为不能据此现象认为Br2氧化性比Fe3+强,理由是
(4)丙同学选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了氧化性:Br2>Fe3+。请在表中写出丙同学可能选用的试剂及实验中观察到的现象(供选用的试剂:a.酚酞试液、b.CCl4、c.无水酒精、d.KSCN溶液)。
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
(5)向FeBr2溶液中通入少量Cl2,发生反应的离子方程式为
您最近一年使用:0次
解题方法
6 . 氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。某化学兴趣小组用氯气和相应的碱溶液反应制取NaClO和 ,制备装置如图所示(部分加持仪器略去),并研究
,制备装置如图所示(部分加持仪器略去),并研究 的氧化性。已知:氯气与碱反应,温度较高时生成
的氧化性。已知:氯气与碱反应,温度较高时生成 ,温度较低时生成
,温度较低时生成 。
。

(1)盛装浓盐酸的仪器名称是_______ 。
(2)装置A烧瓶中反应的化学方程式为_______ 。
(3)装置C中 与试剂a反应的离子方程式为
与试剂a反应的离子方程式为_______ 。
(4)如果缺少装置B,对制取NaClO和 的影响是
的影响是_______ 。
(5)E中可选用试剂有_______ (填标号)。
A.饱和 溶液 B.浓
溶液 B.浓 C.饱和NaCl溶液 D.NaOH溶液
C.饱和NaCl溶液 D.NaOH溶液
(6)该小组在探究 氧化性时,发现
氧化性时,发现 与
与 的反应速率先增大后减小,反应为
的反应速率先增大后减小,反应为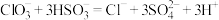 。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究
。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究 对化学反应速率的影响,设计如下实验:
对化学反应速率的影响,设计如下实验:
该实验_______ (填“能”或“不能”)达到实验目的,理由是_______ 。
 ,制备装置如图所示(部分加持仪器略去),并研究
,制备装置如图所示(部分加持仪器略去),并研究 的氧化性。已知:氯气与碱反应,温度较高时生成
的氧化性。已知:氯气与碱反应,温度较高时生成 ,温度较低时生成
,温度较低时生成 。
。
(1)盛装浓盐酸的仪器名称是
(2)装置A烧瓶中反应的化学方程式为
(3)装置C中
 与试剂a反应的离子方程式为
与试剂a反应的离子方程式为(4)如果缺少装置B,对制取NaClO和
 的影响是
的影响是(5)E中可选用试剂有
A.饱和
 溶液 B.浓
溶液 B.浓 C.饱和NaCl溶液 D.NaOH溶液
C.饱和NaCl溶液 D.NaOH溶液(6)该小组在探究
 氧化性时,发现
氧化性时,发现 与
与 的反应速率先增大后减小,反应为
的反应速率先增大后减小,反应为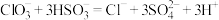 。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究
。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究 对化学反应速率的影响,设计如下实验:
对化学反应速率的影响,设计如下实验:| 实验序号 | 温度 |  | 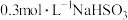 |  盐酸 盐酸 |  |
| ① | 25℃ | 10mL | 10mL | 0mL | 1mL |
| ② | 25℃ | 10mL | 10mL | 1mL | 0mL |
您最近一年使用:0次
2021-06-17更新
|
401次组卷
|
2卷引用:河南省郑州市2020-2021学年高一下学期期末考试化学试题
名校
7 . R、T、X、Y、Z是短周期中的5种主族元素,它们在元素周期表中的位置如下:
已知:R的一种同位素常用来测定一些文物的年代,请回答下列问题:
(1)R、T、X的原子半径从大到小的顺序是_______ (用元素符号表示)。
(2)下列能说明Z的非金属性强于Y的是_______(填字母选项)。
(3)T的最常见氢化物(1分子内含有10个电子)。
①实验室制取该物质的反应的化学方程式为_______ 。
②该物质经催化氧化可得到T的某种氧化物,工业上经过一系列反应,最终可以制得硝酸。请写出该物质催化氧化的化学方程式_______ 。
(4)将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生YX2气体。产生YX2气体的反应的化学方程式为_______ 。
(5)在常温下,将Z2通入NaOH溶液中,可以得到一种漂白液。该反应的离子方程式为_______ 。
| R | T | X | |
| Y | Z |
(1)R、T、X的原子半径从大到小的顺序是
(2)下列能说明Z的非金属性强于Y的是_______(填字母选项)。
| A.Z的气态氢化物比Y的气态氢化物稳定 |
| B.Z单质能从Na2Y溶液中置换出Y单质 |
C. 的还原性强于 的还原性强于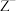 |
| D.Z的氧化物对应水合物的酸性强于Y的氧化物对应水合物的酸性 |
①实验室制取该物质的反应的化学方程式为
②该物质经催化氧化可得到T的某种氧化物,工业上经过一系列反应,最终可以制得硝酸。请写出该物质催化氧化的化学方程式
(4)将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生YX2气体。产生YX2气体的反应的化学方程式为
(5)在常温下,将Z2通入NaOH溶液中,可以得到一种漂白液。该反应的离子方程式为
您最近一年使用:0次
8 . 下列实验操作与现象、实验结论均正确的是
| 选项 | 实验操作与现象 | 实验结论 |
| A | 将二氧化硫气体通入紫色石蕊试液中,溶液褪色 | 二氧化硫具有漂白性 |
| B | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到上层液体呈紫色 | Br2的氧化性强于I2 |
| C | 向X稀溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | X中无NH4+ |
| D | 分别向2mL品红溶液和2mL加入醋酸酸化的品红溶液中滴入3滴84消毒液,观察到后者溶液很快褪色 | 溶液pH减小,84消毒液氧化能力增强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-07-09更新
|
202次组卷
|
2卷引用:河南省许昌市建安区第三高级中学2020-2021学年高一上学期月考化学试题



