名校
解题方法
1 . 下列每组的叙述Ⅰ、Ⅱ都正确,且有因果关系的是
| 叙述Ⅰ | 叙述Ⅱ | |
| A | 实验室中可通加热固体氯化铵的方法制备氨气 | 氯化铵受热易分解生成氨气 |
| B | 将纯净的 通入紫色石蕊试液中,溶液褪色 通入紫色石蕊试液中,溶液褪色 |  有漂白性 有漂白性 |
| C | 断裂 分子中H-N键要吸收热量 分子中H-N键要吸收热量 | 工业上用液氨作制冷剂 |
| D | 取少量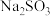 固体样品溶于蒸馏水,加入足量稀盐酸,再加入足量 固体样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液,若有白色沉淀产生,说明产品已变质 溶液,若有白色沉淀产生,说明产品已变质 | 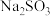 暴露于空气中容易被氧化为 暴露于空气中容易被氧化为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列说法正确的是
| A.实验室中可通过加热氯化铵固体制取氨气 |
| B.常温下,可以用铝罐贮存浓硫酸和浓硝酸,说明铝与浓硫酸和浓硝酸不反应 |
| C.在胆矾中加入浓硫酸后,胆矾由蓝色变为白色,说明浓硫酸具有吸水性 |
| D.将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红,说明原样品已变质 |
您最近一年使用:0次
2021-07-03更新
|
210次组卷
|
3卷引用:山西省长治第二中学2020-2021学年高一下学期期末考试化学试题
3 . 工业上用饱和食盐水吸收尾气 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):

已知:浓硫酸的沸点为338℃。回答下列问题:
(1)导气管b的作用___________ 。
(2)装置B中发生的化学反应的化学方程式为___________ 。
(3)固、固加热制取氨气的发生装置可以选择下图中的___________ (填编号),反应的化学方程式为___________ 。
C.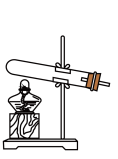 D.
D.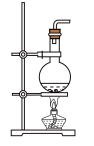 E.
E.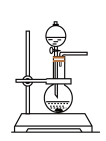 F.
F.
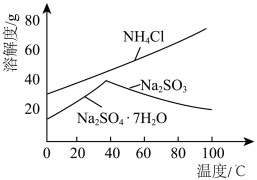
(4)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得___________ ,然后将滤液___________ 、过滤、洗涤、干燥可得另一产物。
(5)产品中可能混有少量 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是___________ ,检验产品中含有 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,___________ 。
【可选试剂:稀硝酸、 溶液、酸性
溶液、酸性 溶液、
溶液、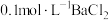 溶液、
溶液、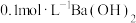 溶液、
溶液、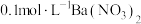 溶液】
溶液】
 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
已知:浓硫酸的沸点为338℃。回答下列问题:
(1)导气管b的作用
(2)装置B中发生的化学反应的化学方程式为
(3)固、固加热制取氨气的发生装置可以选择下图中的
C.
 D.
D. E.
E. F.
F.
(4)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得

(5)产品中可能混有少量
 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,【可选试剂:稀硝酸、
 溶液、酸性
溶液、酸性 溶液、
溶液、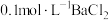 溶液、
溶液、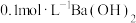 溶液、
溶液、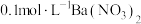 溶液】
溶液】
您最近一年使用:0次
名校
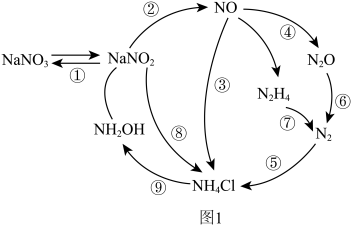
4 . 近年来,人们对微生物的氮转化进行了深入研究,将其归纳为如图1所示过程。请回答下列问题:
(1)N2的电子式为_____ ;羟胺(NH2OH)的结构式为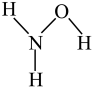 ,属于
,属于_____ (填“离子”或“共价”)化合物。
(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:_____ 。
(3)图1转化过程中具有固氮功能的是_____ (填标号)。
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。
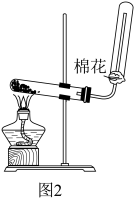
I.写出该反应的化学方程式:_____ 。
Ⅱ.棉花的作用为_____ 。
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。
I.请配平该离子方程式:_____ 。
Ⅱ.NaNO2的质量分数为_____ %。

(1)N2的电子式为
 ,属于
,属于(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:
(3)图1转化过程中具有固氮功能的是
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。

I.写出该反应的化学方程式:
Ⅱ.棉花的作用为
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO
 +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。I.请配平该离子方程式:
Ⅱ.NaNO2的质量分数为
您最近一年使用:0次
2023-04-18更新
|
403次组卷
|
3卷引用:辽宁省部分学校联考2022-2023学年高一下学期4月月考化学试题
名校
解题方法
5 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,合成氨是人类发展史上的一项重大突破。某化学兴趣小组对氨气进行研究:
I. 催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如下图所示:
催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如下图所示:
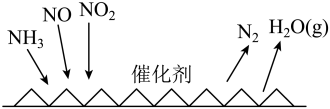
(1)SCR催化反应器中 还原
还原 的化学方程式为
的化学方程式为_______ 。
II.用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。

(2)若氨气的发生装置选择A,则其化学反应方程式为_______ 。
(3)若要用C装置来干燥 ,可以选用的干燥剂为
,可以选用的干燥剂为_______ 。
(4)上述D、E、F、G装置可用于作为氨气的尾气处理装置的是_______ 。
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
已知:CuO在高温时不稳定,会自身分解得到红色的

①实验结束后H处硬质玻璃管中黑色粉末变成红色,该红色粉末的成分能否确定?_______ (填“能”或“否”)。请通过检验其他产物证明 和CuO发生了反应,简述实验方案:
和CuO发生了反应,简述实验方案:_______ 。
②若经实验测定 和CuO反应的产物有Cu和无污染气体,则
和CuO反应的产物有Cu和无污染气体,则 和CuO反应的化学方程式为
和CuO反应的化学方程式为_______ 。
(6)已知加热条件下,氨气可以与铝发生置换反应生成AlN;AlN性质稳定,加热时溶于浓碱溶液且可产生氨气。称取AlN样品23.2 g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56 L(标准状况),则样品中AlN的质量分数为_______ %(保留一位小数)。
I.
 催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如下图所示:
催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如下图所示:
(1)SCR催化反应器中
 还原
还原 的化学方程式为
的化学方程式为II.用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。

(2)若氨气的发生装置选择A,则其化学反应方程式为
(3)若要用C装置来干燥
 ,可以选用的干燥剂为
,可以选用的干燥剂为(4)上述D、E、F、G装置可用于作为氨气的尾气处理装置的是
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
已知:CuO在高温时不稳定,会自身分解得到红色的


①实验结束后H处硬质玻璃管中黑色粉末变成红色,该红色粉末的成分能否确定?
 和CuO发生了反应,简述实验方案:
和CuO发生了反应,简述实验方案:②若经实验测定
 和CuO反应的产物有Cu和无污染气体,则
和CuO反应的产物有Cu和无污染气体,则 和CuO反应的化学方程式为
和CuO反应的化学方程式为(6)已知加热条件下,氨气可以与铝发生置换反应生成AlN;AlN性质稳定,加热时溶于浓碱溶液且可产生氨气。称取AlN样品23.2 g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56 L(标准状况),则样品中AlN的质量分数为
您最近一年使用:0次
2023-03-07更新
|
716次组卷
|
2卷引用:湖南省长沙市第一中学2022-2023学年高一下学期第一次月考(3月)化学试题
6 . 工业上用饱和食盐水吸收尾气 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):

已知:浓硫酸的沸点为338℃。回答下列问题:
(1)仪器a的名称_______ ,导气管b的作用_______ 。
(2)装置A中发生的化学反应的化学方程式为_______ 。
(3)固、固加热制取氨气的发生装置可以选择下图中的_______ (填编号),反应的化学方程式为_______ 。

(4)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得_______ ,然后将滤液_______ 、过滤、洗涤、干燥可得另一产物。

(5)产品中可能混有少量 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是_______ ,检验产品中含有 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,_______ 。
【可选试剂:稀硝酸、 溶液、酸性
溶液、酸性 溶液、
溶液、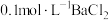 溶液、
溶液、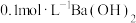 溶液、
溶液、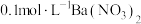 溶液】
溶液】
 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
已知:浓硫酸的沸点为338℃。回答下列问题:
(1)仪器a的名称
(2)装置A中发生的化学反应的化学方程式为
(3)固、固加热制取氨气的发生装置可以选择下图中的

(4)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得

(5)产品中可能混有少量
 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,【可选试剂:稀硝酸、
 溶液、酸性
溶液、酸性 溶液、
溶液、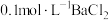 溶液、
溶液、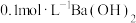 溶液、
溶液、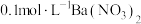 溶液】
溶液】
您最近一年使用:0次
2023-02-25更新
|
986次组卷
|
4卷引用:广东省茂名市电白区2021-2022学年高一下学期期末(选择性)考试化学试题
解题方法
7 .  既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
Ⅰ.实验室中制备NaN3分2步进行:
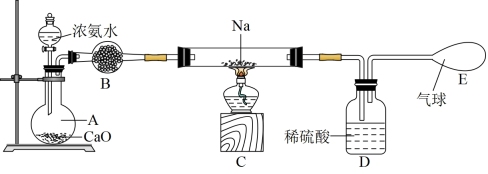
①制备氨基钠: ,装置如下图。已知氨基钠极易与水剧烈反应生成
,装置如下图。已知氨基钠极易与水剧烈反应生成 ,且易被空气氧化。
,且易被空气氧化。
②制备叠氮化钠:将得到的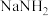 与
与 在210~220℃的条件下反应生成
在210~220℃的条件下反应生成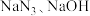 和
和 。
。
(1)盛放浓氨水的仪器名称为_______ ,B的作用是_______ 。
(2)连接好装置并检查装置的气密性后,装入试剂,然后应先_______ 。
a.向A中加入浓氨水 b.加热装置C
(3)若无B装置,C中生成的氨基钠会发生的化学方程式为_______ 。
(4)D装置中长导管不伸入液面的目的是_______ 。
(5) 可由
可由 (熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是
(熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是_______ (填标号)。
a. b.
b.  c.
c. 
Ⅱ.测定的纯度
精确称量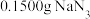 样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知:
样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知: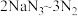 (其他产物略),反应中放出大量的热。
(其他产物略),反应中放出大量的热。
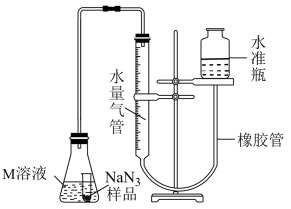
(6)常温下测得产生气体的体积为45.00mL ( 的密度为1.400g/L),计算
的密度为1.400g/L),计算 样品的纯度为(质量分数)
样品的纯度为(质量分数)_______ 。
 既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。Ⅰ.实验室中制备NaN3分2步进行:
①制备氨基钠:
 ,装置如下图。已知氨基钠极易与水剧烈反应生成
,装置如下图。已知氨基钠极易与水剧烈反应生成 ,且易被空气氧化。
,且易被空气氧化。
②制备叠氮化钠:将得到的
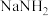 与
与 在210~220℃的条件下反应生成
在210~220℃的条件下反应生成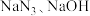 和
和 。
。(1)盛放浓氨水的仪器名称为
(2)连接好装置并检查装置的气密性后,装入试剂,然后应先
a.向A中加入浓氨水 b.加热装置C
(3)若无B装置,C中生成的氨基钠会发生的化学方程式为
(4)D装置中长导管不伸入液面的目的是
(5)
 可由
可由 (熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是
(熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是a.
 b.
b.  c.
c. 
Ⅱ.测定的纯度
精确称量
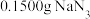 样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知:
样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知: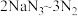 (其他产物略),反应中放出大量的热。
(其他产物略),反应中放出大量的热。
(6)常温下测得产生气体的体积为45.00mL (
 的密度为1.400g/L),计算
的密度为1.400g/L),计算 样品的纯度为(质量分数)
样品的纯度为(质量分数)
您最近一年使用:0次
名校
8 . 某化学实验小组为了探究氨气的性质设计了如图实验装置:
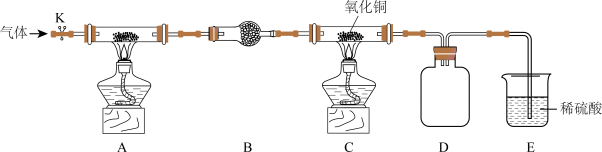
已知:CuO在高温时不稳定,会分解得到Cu2O,Cu2O粉末呈红色。
(1)实验前需先通入一段时间某气体,该气体可以是____ (填字母)。
a.空气b.氩气c.氢气
装置A用于制备氨气,选择的试剂通常是____ (填化学式)。
(2)装置D、E的作用分别是____ 、____ 。
(3)经实验测定NH3和CuO反应的产物有N2和Cu,则NH3和CuO反应的化学方程式为____ 。
(4)实验结束后装置c中黑色粉末变成红色,该红色粉末的成分能否确定?____ (填“能”或“否”)。请通过检验其他产物证明NH3和CuO发生了反应,简述实验方案:____ 。
(5)加热条件下,氨气可以与铝发生置换反应生成AlN;AlN性质稳定,加热时溶于浓碱溶液且可产生氨气。
①写出氨气与铝反应的化学方程式:____ 。
②称取AlN样品23.2g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56L(标准状况),则样品中AlN的质量分数为____ %(保留一位小数)。

已知:CuO在高温时不稳定,会分解得到Cu2O,Cu2O粉末呈红色。
(1)实验前需先通入一段时间某气体,该气体可以是
a.空气b.氩气c.氢气
装置A用于制备氨气,选择的试剂通常是
(2)装置D、E的作用分别是
(3)经实验测定NH3和CuO反应的产物有N2和Cu,则NH3和CuO反应的化学方程式为
(4)实验结束后装置c中黑色粉末变成红色,该红色粉末的成分能否确定?
(5)加热条件下,氨气可以与铝发生置换反应生成AlN;AlN性质稳定,加热时溶于浓碱溶液且可产生氨气。
①写出氨气与铝反应的化学方程式:
②称取AlN样品23.2g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56L(标准状况),则样品中AlN的质量分数为
您最近一年使用:0次
2022-07-12更新
|
393次组卷
|
3卷引用:河北省沧州市2021-2022学年高一下学期期末考试化学试题
9 . 工业上用饱和食盐水吸收尾气 和
和 制备无水
制备无水 ,同时得到副产物
,同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):

已知:浓硫酸的沸点为338℃.回答下列问题:
(1)仪器a的名称_______ ,导气管b的作用_______ .
(2)装置A中发生的化学反应的化学方程式为_______ .
(3)氨气的发生装置可以选择下图中的_______ (填编号),反应的化学方程式为_______ .
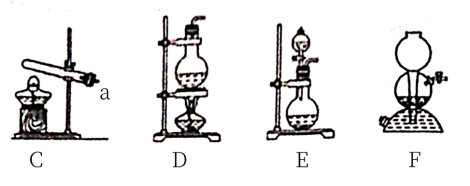
(4)利用各物质的溶解度曲线图(见图)分离产品.取出装置B中的溶液,蒸发浓缩,趁热过滤可得_______ ,然后将滤液_______ 、过滤、洗涤、干燥可得另一产物.

(5)产品中可能混有少量 和
和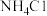 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是_______ 检验产品中含有 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,_______ 。【可选试剂:稀硝酸、 溶液、酸性
溶液、酸性 溶液、
溶液、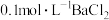 溶液、
溶液、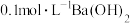 溶液、
溶液、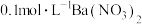 溶液】
溶液】
 和
和 制备无水
制备无水 ,同时得到副产物
,同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
已知:浓硫酸的沸点为338℃.回答下列问题:
(1)仪器a的名称
(2)装置A中发生的化学反应的化学方程式为
(3)氨气的发生装置可以选择下图中的

(4)利用各物质的溶解度曲线图(见图)分离产品.取出装置B中的溶液,蒸发浓缩,趁热过滤可得

(5)产品中可能混有少量
 和
和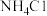 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解, 溶液、酸性
溶液、酸性 溶液、
溶液、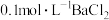 溶液、
溶液、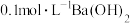 溶液、
溶液、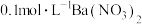 溶液】
溶液】
您最近一年使用:0次



