1 . 二氧化硫具有漂白性,工业上常用二氧化硫来漂白纸浆、毛、丝、草帽等。此外二氧化硫还能够抑制霉菌和细菌的滋生,可用作防腐剂,甲组同学拟利用Mg粉与浓硫酸反应制取22.4L(标准状况下)SO2。实验方案设计如下:取 粉与
粉与 的浓硫酸(含
的浓硫酸(含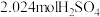 )混合,加热充分反应,待Mg粉全部溶解后,干燥并收集气体。
)混合,加热充分反应,待Mg粉全部溶解后,干燥并收集气体。
(1)写出Mg粉与浓硫酸反应制备 的化学方程式:
的化学方程式:_______ 。
(2)乙组同学认为:按甲组同学实验方案无法达到实验目的,并且制得气体应该含有杂质,该杂质为___ (填化学式)。
(3)为了检验甲组同学所制气体的成分,乙组同学按甲组同学的实验方案制备气体,并设计了如图所示的实验装置进行检验(已知酸性高锰酸钾溶液及B中试剂均过量)。
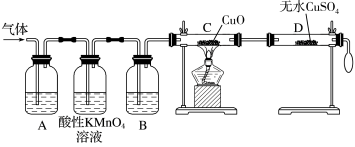
①A中试剂是品红溶液,作用是_______ 。
②B中所装试剂为_______ 。
③证明气体中混有杂质气体的实验现象是:_______ 。
(4)SO2是常见的大气污染物,丙组同学认为 溶液可以做
溶液可以做 的吸收液,从而减少实验室
的吸收液,从而减少实验室 的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):

反应开始后,B、C试管中除了有气泡外,未见其他现象;D中红色褪去。通过乙组同学的实验,得出的结论是____ 。
 粉与
粉与 的浓硫酸(含
的浓硫酸(含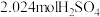 )混合,加热充分反应,待Mg粉全部溶解后,干燥并收集气体。
)混合,加热充分反应,待Mg粉全部溶解后,干燥并收集气体。(1)写出Mg粉与浓硫酸反应制备
 的化学方程式:
的化学方程式:(2)乙组同学认为:按甲组同学实验方案无法达到实验目的,并且制得气体应该含有杂质,该杂质为
(3)为了检验甲组同学所制气体的成分,乙组同学按甲组同学的实验方案制备气体,并设计了如图所示的实验装置进行检验(已知酸性高锰酸钾溶液及B中试剂均过量)。

①A中试剂是品红溶液,作用是
②B中所装试剂为
③证明气体中混有杂质气体的实验现象是:
(4)SO2是常见的大气污染物,丙组同学认为
 溶液可以做
溶液可以做 的吸收液,从而减少实验室
的吸收液,从而减少实验室 的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
反应开始后,B、C试管中除了有气泡外,未见其他现象;D中红色褪去。通过乙组同学的实验,得出的结论是
您最近一年使用:0次
2 . 二氧化硫具有漂白性,工业上常用二氧化硫来漂白纸浆、毛、丝、草帽等。此外二氧化硫还能够抑制霉菌和细菌的滋生,可用作防腐剂。
Ⅰ.甲组同学拟利用 粉与浓硫酸反应制取
粉与浓硫酸反应制取 (标准状况下)
(标准状况下) 。实验方案设计如下:取
。实验方案设计如下:取 粉与
粉与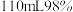 的浓硫酸(含
的浓硫酸(含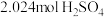 )混合,加热充分反应,待
)混合,加热充分反应,待 粉全部溶解后,干燥并收集气体。
粉全部溶解后,干燥并收集气体。
(1)写出 粉与浓硫酸反应制备
粉与浓硫酸反应制备 的化学方程式:
的化学方程式:__________________ 。
(2)乙组同学认为:按甲组同学实验方案无法达到实验目的,并且制得气体应该含有杂质,该杂质为_________ (填化学式)。
(3)为了检验甲组同学所制气体的成分,乙组同学按甲组同学的实验方案制备气体,并设计了如图所示的实验装置进行检验。(已知酸性高锰酸钾溶液及B中试剂均过量)
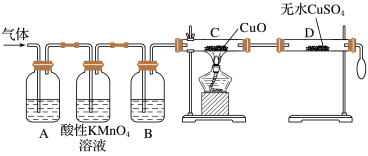
①A中试剂是品红溶液,作用是____________ 。
②B中所装试剂为____________ 。
③证明气体中混有杂质气体的实验现象是:________ 。
Ⅱ. 是常见的大气污染物,燃煤是产生
是常见的大气污染物,燃煤是产生 的主要原因。
的主要原因。
(4)工业上有多种方法可以减少 的排放。往煤中添加一些石灰石,可使燃煤过程中产生的
的排放。往煤中添加一些石灰石,可使燃煤过程中产生的 转化成硫酸钙,该反应的化学方程式是
转化成硫酸钙,该反应的化学方程式是___________ 。
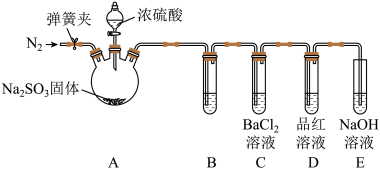
(5)丙组同学认为 溶液可以做
溶液可以做 的吸收液,从而减少实验室
的吸收液,从而减少实验室 的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
已知: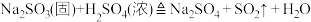
反应开始后,B、C试管中除了有气泡外,未见其他现象;D中红色褪去。通过乙组同学的实验,得出的结论是___________ 。
Ⅰ.甲组同学拟利用
 粉与浓硫酸反应制取
粉与浓硫酸反应制取 (标准状况下)
(标准状况下) 。实验方案设计如下:取
。实验方案设计如下:取 粉与
粉与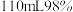 的浓硫酸(含
的浓硫酸(含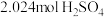 )混合,加热充分反应,待
)混合,加热充分反应,待 粉全部溶解后,干燥并收集气体。
粉全部溶解后,干燥并收集气体。(1)写出
 粉与浓硫酸反应制备
粉与浓硫酸反应制备 的化学方程式:
的化学方程式:(2)乙组同学认为:按甲组同学实验方案无法达到实验目的,并且制得气体应该含有杂质,该杂质为
(3)为了检验甲组同学所制气体的成分,乙组同学按甲组同学的实验方案制备气体,并设计了如图所示的实验装置进行检验。(已知酸性高锰酸钾溶液及B中试剂均过量)

①A中试剂是品红溶液,作用是
②B中所装试剂为
③证明气体中混有杂质气体的实验现象是:
Ⅱ.
 是常见的大气污染物,燃煤是产生
是常见的大气污染物,燃煤是产生 的主要原因。
的主要原因。(4)工业上有多种方法可以减少
 的排放。往煤中添加一些石灰石,可使燃煤过程中产生的
的排放。往煤中添加一些石灰石,可使燃煤过程中产生的 转化成硫酸钙,该反应的化学方程式是
转化成硫酸钙,该反应的化学方程式是(5)丙组同学认为
 溶液可以做
溶液可以做 的吸收液,从而减少实验室
的吸收液,从而减少实验室 的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
已知:
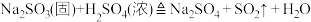
反应开始后,B、C试管中除了有气泡外,未见其他现象;D中红色褪去。通过乙组同学的实验,得出的结论是
您最近一年使用:0次
名校
解题方法
3 . 甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
(1)A中反应的化学方程式是_______ 。
(2)C中白色沉淀是_______ (填化学式,下同),C中液面上方生成的浅棕色气体是_______ 。
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_______ ;乙在A、B间增加洗气瓶D,D中盛放的试剂是_______ 。
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸,请写出乙中产生少量白色沉淀的离子方程式:_______ 。
(4)合并(3)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,根据甲、乙同学的实验目的可得出的结论是_______ 。
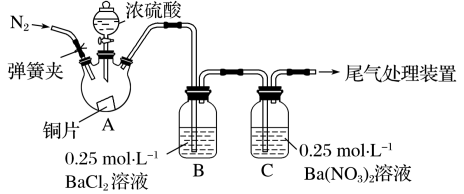
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(2)C中白色沉淀是
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
(4)合并(3)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,根据甲、乙同学的实验目的可得出的结论是
您最近一年使用:0次
2021-08-02更新
|
675次组卷
|
4卷引用:重庆市第八中学2020-2021学年高一下学期期中考试化学试题
名校
解题方法
4 . 有关下列实验装置能达到实验目的的是




A.甲装置:0.1000mol/L的标准 溶液滴定未知浓度 溶液滴定未知浓度 溶液 溶液 |
B.乙装置:启停自如地制备 |
| C.丙装置:观察钾元素的焰色 |
D.丁装置:检验 中是否混有 中是否混有 |
您最近一年使用:0次
名校
5 . 下列实验装置能达到相应实验目的的是
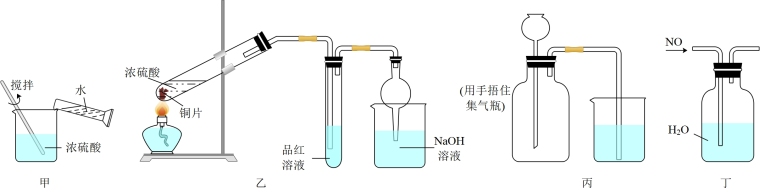
| A.装置甲稀释浓硫酸 |
| B.装置乙制备并检验SO2气体的性质 |
| C.装置丙检查装置的气密性 |
| D.装置丁收集NO |
您最近一年使用:0次
2022-03-23更新
|
539次组卷
|
9卷引用:重庆市育才中学2021-2022学年高一下学期第一次月考化学试题
6 . 下列实验操作正确且能达到实验目的的是
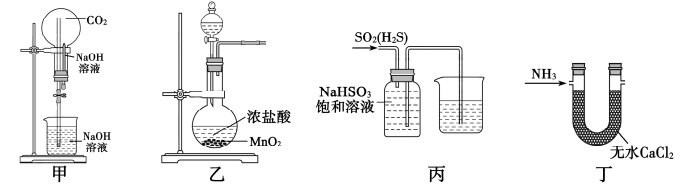

| A.用甲装置做喷泉实验 | B.用乙装置制备氯气 |
C.用丙装置提纯 气体 气体 | D.用丁装置干燥 |
您最近一年使用:0次
2021-07-14更新
|
174次组卷
|
3卷引用:重庆市实验中学2021-2022学年高一下学期第一次月考化学试题
解题方法
7 . 某化学兴趣小组用以下装置制备 并探究其部分性质。
并探究其部分性质。
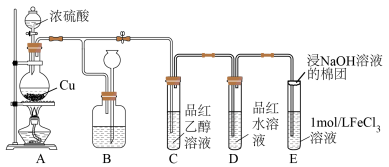
(1)装置A中制备 的化学反应方程式为
的化学反应方程式为___________ ,装置B可贮存多余的 ,B中试剂瓶内应盛放的液体是
,B中试剂瓶内应盛放的液体是___________ (填字母)。
a. 溶液 b.饱和
溶液 b.饱和 溶液 c.水 d.溴水
溶液 c.水 d.溴水
(2)若装置C中溶液无明显现象,装置D中溶液红色褪去,说明使品红水溶液褪色的含硫微粒一定不是___________ (填化学式)。
(3)通入 后,E中溶液立即由棕黄色变成红棕色,将混合液静置12小时后,溶液变成浅绿色。查阅资料,发现溶液出现红棕色是因为
后,E中溶液立即由棕黄色变成红棕色,将混合液静置12小时后,溶液变成浅绿色。查阅资料,发现溶液出现红棕色是因为 (红棕色)。
(红棕色)。
①溶液中产生 的离子方程式为
的离子方程式为___________ 。与该过程发生的其他化学反应相比, 与
与 反应生成
反应生成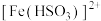 的反应速率
的反应速率___________ (填“快”或“慢”)。
②红棕色的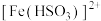 与
与 反应,溶液变成浅绿色,反应的离子方程式为
反应,溶液变成浅绿色,反应的离子方程式为___________ ,与该过程发生的其他化学反应相比,该反应的反应速率___________ (填“快”或“慢”)。
③为了缩短红棕色变为浅绿色的时间,该小组进行如下实验:
实验Ⅰ:往5mL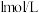
 溶液中通入
溶液中通入 ,微热3分钟,溶液变为浅绿色。
,微热3分钟,溶液变为浅绿色。
实验Ⅱ:用浓盐酸酸化 溶液后再通入
溶液后再通入 ,几分钟后,溶液变为浅绿色。
,几分钟后,溶液变为浅绿色。
结论:通过___________ 可缩短浅绿色出现的时间。
 并探究其部分性质。
并探究其部分性质。
(1)装置A中制备
 的化学反应方程式为
的化学反应方程式为 ,B中试剂瓶内应盛放的液体是
,B中试剂瓶内应盛放的液体是a.
 溶液 b.饱和
溶液 b.饱和 溶液 c.水 d.溴水
溶液 c.水 d.溴水(2)若装置C中溶液无明显现象,装置D中溶液红色褪去,说明使品红水溶液褪色的含硫微粒一定不是
(3)通入
 后,E中溶液立即由棕黄色变成红棕色,将混合液静置12小时后,溶液变成浅绿色。查阅资料,发现溶液出现红棕色是因为
后,E中溶液立即由棕黄色变成红棕色,将混合液静置12小时后,溶液变成浅绿色。查阅资料,发现溶液出现红棕色是因为 (红棕色)。
(红棕色)。①溶液中产生
 的离子方程式为
的离子方程式为 与
与 反应生成
反应生成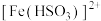 的反应速率
的反应速率②红棕色的
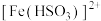 与
与 反应,溶液变成浅绿色,反应的离子方程式为
反应,溶液变成浅绿色,反应的离子方程式为③为了缩短红棕色变为浅绿色的时间,该小组进行如下实验:
实验Ⅰ:往5mL
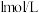
 溶液中通入
溶液中通入 ,微热3分钟,溶液变为浅绿色。
,微热3分钟,溶液变为浅绿色。实验Ⅱ:用浓盐酸酸化
 溶液后再通入
溶液后再通入 ,几分钟后,溶液变为浅绿色。
,几分钟后,溶液变为浅绿色。结论:通过
您最近一年使用:0次
8 .  是中学化学重要的氧化物之一,在生产、生活中应用也十分广泛。某化学兴趣小组为制备、收集并探究
是中学化学重要的氧化物之一,在生产、生活中应用也十分广泛。某化学兴趣小组为制备、收集并探究 的性质。利用下图装置进行实验。
的性质。利用下图装置进行实验。

(1)装置A中,盛装浓硫酸的仪器名称是___________ 。
(2)装置B中盛装的也是浓硫酸,装置B的作用是___________ 。
(3)装置D中的现象为___________ ;体现了 的
的___________ 性。
(4)装置D中,浸有 溶液的碱性棉球的作用是
溶液的碱性棉球的作用是___________ 。若将碱性棉球改为浸 溶液,会在棉球上出现黄色固体,该反应的化学方程式为
溶液,会在棉球上出现黄色固体,该反应的化学方程式为___________ 。
(5)若将 通入
通入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为___________ 。检验生成的阴离子的实验操作及现象是___________ 。
 是中学化学重要的氧化物之一,在生产、生活中应用也十分广泛。某化学兴趣小组为制备、收集并探究
是中学化学重要的氧化物之一,在生产、生活中应用也十分广泛。某化学兴趣小组为制备、收集并探究 的性质。利用下图装置进行实验。
的性质。利用下图装置进行实验。
(1)装置A中,盛装浓硫酸的仪器名称是
(2)装置B中盛装的也是浓硫酸,装置B的作用是
(3)装置D中的现象为
 的
的(4)装置D中,浸有
 溶液的碱性棉球的作用是
溶液的碱性棉球的作用是 溶液,会在棉球上出现黄色固体,该反应的化学方程式为
溶液,会在棉球上出现黄色固体,该反应的化学方程式为(5)若将
 通入
通入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为
您最近一年使用:0次
9 . 常温下,氧化二氯(Cl2O)是棕黄色刺激性气体,是一种高效的氧化剂,沸点3.8℃,易溶于CCl4,遇水易生成不稳定的HClO。实验室制备Cl2O的反应原理为:2Cl2+2HgO=HgCl2•HgO+Cl2O。现用下列装置制备少量Cl2O(加热和夹持装置略去)。

已知:HgCl2•HgO是难溶于CCl4的固体。回答下列问题:
(1)各装置的连接顺序为A→ → →D→ →E(填字母,装置可以重复使用)___ 。
(2)A为氯气发生装置,A中发生反应的离子方程式为___ (锰被还原为Mn2+)。
(3)C装置的作用是___ ,若没有B装置,D中除发生主反应外,还可能发生反应的化学方程式是___ 。
(4)装置D中的操作:把CCl4加入三颈瓶中,用冰水浴冷却,通入氯气至浓度达到50 g/L,停止供氯。加入HgO固体,加热三颈瓶至25℃,搅拌45 min,氯气几乎完全反应。过滤三颈瓶内的混合物。若实验前后D中液体体积不变,测得滤液中Cl2O的浓度为24.5 g/L,则Cl2O的产率=___ 。(保留两位有效数字)。
(5)实验完成后,取E中烧杯内溶液滴加品红溶液,发现溶液褪色。该课题组设计实验探究溶液褪色的原因。
①A=___ 。
②由上述实验I、III得出的结论是___ 。

已知:HgCl2•HgO是难溶于CCl4的固体。回答下列问题:
(1)各装置的连接顺序为A→ → →D→ →E(填字母,装置可以重复使用)
(2)A为氯气发生装置,A中发生反应的离子方程式为
(3)C装置的作用是
(4)装置D中的操作:把CCl4加入三颈瓶中,用冰水浴冷却,通入氯气至浓度达到50 g/L,停止供氯。加入HgO固体,加热三颈瓶至25℃,搅拌45 min,氯气几乎完全反应。过滤三颈瓶内的混合物。若实验前后D中液体体积不变,测得滤液中Cl2O的浓度为24.5 g/L,则Cl2O的产率=
(5)实验完成后,取E中烧杯内溶液滴加品红溶液,发现溶液褪色。该课题组设计实验探究溶液褪色的原因。
| 序号 | 0.1 mol/LNaClO溶液/mL | 0.1 mol/LNaCl溶液/mL | 0.1 mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| I | 5.0 | 0 | 0 | 5.0 | 3滴 | 较快褪色 |
| II | 0 | 5.0 | A | 0 | 3滴 | 不褪色 |
| III | 5.0 | 0 | 5.0 | 0 | 3滴 | 较慢褪色 |
②由上述实验I、III得出的结论是
您最近一年使用:0次
2021-10-27更新
|
252次组卷
|
4卷引用:重庆市缙云教育联盟2021-2022学年高一11月质量检测化学试题
10 . 硫元素是一种非金属元素,硫的化合物广泛应用于工农业生产及生命细胞的生理过程。
Ⅰ.物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据图中所示,回答下列问题:

(1) 具备较强的
具备较强的_______ (填“氧化性”或“还原性”); 在一定条件下与铜反应的化学方程式为
在一定条件下与铜反应的化学方程式为_______ 。
(2) 的浓溶液是实验室常用的化学试剂,下列过程主要表现了它的哪些性质?请将答案的序号分别填在横线上。
的浓溶液是实验室常用的化学试剂,下列过程主要表现了它的哪些性质?请将答案的序号分别填在横线上。
①将适量蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量 的浓溶液,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生刺激性气味的气体
的浓溶液,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生刺激性气味的气体_______ 。
②在 蓝色晶体表面滴加
蓝色晶体表面滴加 的浓溶液,蓝色晶体变白
的浓溶液,蓝色晶体变白_______ 。
A .强酸性 B .强氧化性 C .高沸点、难挥发性 D .脱水性 E .吸水性
(3)预制备 (硫代硫酸钠),从氧化还原的角度分析,下列选项合理的是
(硫代硫酸钠),从氧化还原的角度分析,下列选项合理的是_______ (填序号)。
A . B .
B . C .
C . D .
D .
Ⅱ.巴蜀中学高一化学兴趣小组设计如图实验,探究金属与不同浓度的硫酸的反应并验证其产物的性质,回答下列问题:

已知:浓 的沸点为
的沸点为 。
。
(1)实验Ⅰ中有大量气泡冒出,然而实验Ⅱ在加热前却没有明显实验现象,原因是_______ 。
(2)加热实验Ⅱ中的试管 使温度保持在
使温度保持在 ,观察到
,观察到 中产生大量气体,此时
中产生大量气体,此时 中的现象为
中的现象为_______ ;一段时间以后 中溶液褪色,该反应的离子方程式为
中溶液褪色,该反应的离子方程式为_______ ;实验过程中装置 中有黄色浑浊,该现象
中有黄色浑浊,该现象_______ (填“能”或“不能”)证明 中生成的气体有氧化性,原因是
中生成的气体有氧化性,原因是_______ (溴水的挥发可忽略);装置 中的主要反应的离子方程式为
中的主要反应的离子方程式为_______ 。
(3)实验过程中由于装置密闭性不好导致产生的气体外漏,小组同学将实验室空气样品 (气体体积已折算成标准状况)通入到
(气体体积已折算成标准状况)通入到 的酸性高锰酸钾溶液中进行处理。已知
的酸性高锰酸钾溶液中进行处理。已知 与该溶液反应的离子方程式为:
与该溶液反应的离子方程式为: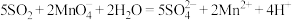 ;当剩余
;当剩余 空气样品时,溶液恰好褪色,假定样品中的
空气样品时,溶液恰好褪色,假定样品中的 可被溶液充分吸收,则实验室空气样品中的
可被溶液充分吸收,则实验室空气样品中的 的含量是
的含量是_______ 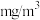 。
。
Ⅰ.物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据图中所示,回答下列问题:

(1)
 具备较强的
具备较强的 在一定条件下与铜反应的化学方程式为
在一定条件下与铜反应的化学方程式为(2)
 的浓溶液是实验室常用的化学试剂,下列过程主要表现了它的哪些性质?请将答案的序号分别填在横线上。
的浓溶液是实验室常用的化学试剂,下列过程主要表现了它的哪些性质?请将答案的序号分别填在横线上。①将适量蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量
 的浓溶液,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生刺激性气味的气体
的浓溶液,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生刺激性气味的气体②在
 蓝色晶体表面滴加
蓝色晶体表面滴加 的浓溶液,蓝色晶体变白
的浓溶液,蓝色晶体变白A .强酸性 B .强氧化性 C .高沸点、难挥发性 D .脱水性 E .吸水性
(3)预制备
 (硫代硫酸钠),从氧化还原的角度分析,下列选项合理的是
(硫代硫酸钠),从氧化还原的角度分析,下列选项合理的是A .
 B .
B . C .
C . D .
D .
Ⅱ.巴蜀中学高一化学兴趣小组设计如图实验,探究金属与不同浓度的硫酸的反应并验证其产物的性质,回答下列问题:

已知:浓
 的沸点为
的沸点为 。
。(1)实验Ⅰ中有大量气泡冒出,然而实验Ⅱ在加热前却没有明显实验现象,原因是
(2)加热实验Ⅱ中的试管
 使温度保持在
使温度保持在 ,观察到
,观察到 中产生大量气体,此时
中产生大量气体,此时 中的现象为
中的现象为 中溶液褪色,该反应的离子方程式为
中溶液褪色,该反应的离子方程式为 中有黄色浑浊,该现象
中有黄色浑浊,该现象 中生成的气体有氧化性,原因是
中生成的气体有氧化性,原因是 中的主要反应的离子方程式为
中的主要反应的离子方程式为(3)实验过程中由于装置密闭性不好导致产生的气体外漏,小组同学将实验室空气样品
 (气体体积已折算成标准状况)通入到
(气体体积已折算成标准状况)通入到 的酸性高锰酸钾溶液中进行处理。已知
的酸性高锰酸钾溶液中进行处理。已知 与该溶液反应的离子方程式为:
与该溶液反应的离子方程式为: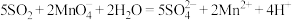 ;当剩余
;当剩余 空气样品时,溶液恰好褪色,假定样品中的
空气样品时,溶液恰好褪色,假定样品中的 可被溶液充分吸收,则实验室空气样品中的
可被溶液充分吸收,则实验室空气样品中的 的含量是
的含量是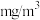 。
。
您最近一年使用:0次



