1 . 某小组同学利用下图所示装置探究 性质。回答下列问题:
性质。回答下列问题:_____ 。
(2)试管② 溶液的作用是
溶液的作用是_____ (用化学方程式解释)。
(3)若X为品红溶液,可观察到试管①中溶液_____ (填实验现象,下同),反应后取下试管①并加热,观察到的现象是_____ 。
(4)若 为酸性
为酸性 溶液,可观察到试管①中溶液由紫色变为无色,由此可知
溶液,可观察到试管①中溶液由紫色变为无色,由此可知 具有
具有_____ (填“氧化性”或“还原性”);推断无色溶液中所含的离子是 、
、 、
、 和
和_____ 。
(5)若 为
为 溶液,写出试管①中反应的化学方程式
溶液,写出试管①中反应的化学方程式_____ 。
 性质。回答下列问题:
性质。回答下列问题:
(2)试管②
 溶液的作用是
溶液的作用是(3)若X为品红溶液,可观察到试管①中溶液
(4)若
 为酸性
为酸性 溶液,可观察到试管①中溶液由紫色变为无色,由此可知
溶液,可观察到试管①中溶液由紫色变为无色,由此可知 具有
具有 、
、 、
、 和
和(5)若
 为
为 溶液,写出试管①中反应的化学方程式
溶液,写出试管①中反应的化学方程式
您最近一年使用:0次
解题方法
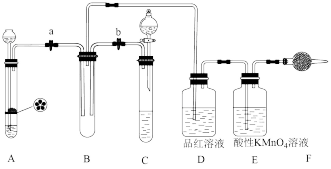
2 . 某课外学习小组的同学设计了如图所示的实验装置(夹持装置略),以验证 的氧化性、还原性和漂白性。
的氧化性、还原性和漂白性。
请回答下列问题:
(1)用Na2SO3固体和70%的浓硫酸反应制取SO2气体,应选用____________ (填“A”或“C”)装置作气体发生装置,不选用另一装置的理由是_______________________________ 。
(2)该课外学习小组的同学用FeS固体和稀硫酸反应制取H2S气体,反应的化学方程式为___________________________ 。
(3)SO2气体通过D装置时的现象是___________________________ ,通过E装置时的现象是__________________________ ;SO2与H2S在B装置中反应,现象是__________________________ 。
(4)F装置中盛有碱石灰,其作用是_______________________________ 。
 的氧化性、还原性和漂白性。
的氧化性、还原性和漂白性。请回答下列问题:
(1)用Na2SO3固体和70%的浓硫酸反应制取SO2气体,应选用
(2)该课外学习小组的同学用FeS固体和稀硫酸反应制取H2S气体,反应的化学方程式为
(3)SO2气体通过D装置时的现象是
(4)F装置中盛有碱石灰,其作用是

您最近一年使用:0次
名校
解题方法
3 . 下列有关二氧化硫的说法中,错误的是
| A.实验室可用氢氧化钠溶液吸收二氧化硫 |
| B.二氧化硫水溶液能使紫色石蕊试液变红,说明二氧化硫与水发生了反应 |
| C.二氧化硫能使酸性高锰酸钾溶液褪色,说明二氧化硫具有还原性 |
| D.二氧化硫能漂白某些物质,说明它具有氧化性 |
您最近一年使用:0次
2022-11-24更新
|
541次组卷
|
2卷引用:苏教2020版化学必修第一册专题4 硫与环境保护 第一单元 含硫化合物的性质课后习题
解题方法
4 . 某小组为验证SO2的性质设计如图所示的实验装置,下列说法错误的是( )
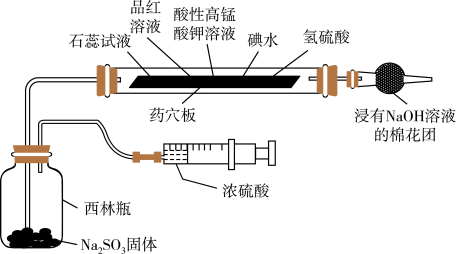

| A.一段时间后石蕊溶液和品红溶液均褪色,说明SO2有漂白性 |
| B.一段时间后酸性高锰酸钾溶液、溴水褪色,说明SO2有还原性 |
| C.一段时间后氢硫酸溶液中有淡黄色沉淀生成,说明SO2有氧化性 |
| D.该装置能体现实验的微型化和绿色化 |
您最近一年使用:0次
2020-06-11更新
|
251次组卷
|
3卷引用:山东省日照市2020届高三校际联合考试(二模)化学试题
解题方法
5 . SO2在生产、生活中具有重要的作用,据所学知识回答相关问题。
(1) SO2通入Na2CO3溶液中有CO2生成,说明H2SO3具有___________ (填“酸性”、“氧化性”、“还原性”或“漂白性”,下同),SO2通入品红溶液中,品红溶液褪色,说明SO2具有___________ 。
(2)已知SO2通入FeCl3溶液会发生反应,还原产物为___________ (填化学式,下同),氧化产物为___________ 。
(3)向含锌粉的悬浊液中通入SO2可制备ZnS2O4。
①该反应的化学方程式为___________ ,若反应中有0.1mol电子转移,则生成ZnS2O4___________ g。
②向反应后的溶液中加入过量盐酸,溶液出现黄色浑浊,且有刺激性气体产生,反应的化学方程式为___________ 。
(4)已知室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。ZnO水悬浊液常用于吸收烟气中的SO2。向ZnO水悬浊液中缓慢匀速通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH的变化如图。0~20min内,溶液pH几乎不变的原因是___________ ,SO2吸收率在30min后迅速降低,其原因是___________ 。

(1) SO2通入Na2CO3溶液中有CO2生成,说明H2SO3具有
(2)已知SO2通入FeCl3溶液会发生反应,还原产物为
(3)向含锌粉的悬浊液中通入SO2可制备ZnS2O4。
①该反应的化学方程式为
②向反应后的溶液中加入过量盐酸,溶液出现黄色浑浊,且有刺激性气体产生,反应的化学方程式为
(4)已知室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。ZnO水悬浊液常用于吸收烟气中的SO2。向ZnO水悬浊液中缓慢匀速通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH的变化如图。0~20min内,溶液pH几乎不变的原因是

您最近一年使用:0次
2021-01-21更新
|
575次组卷
|
4卷引用:陕西省安康市2021届高三第一次教学质量联考化学试题
陕西省安康市2021届高三第一次教学质量联考化学试题(已下线)第06讲 氧化还原反应(精练)-2022年高考化学一轮复习讲练测(已下线)第06讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(全国通用)新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
6 . 下列叙述Ⅰ和叙述Ⅱ均正确且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4可以发生 |
| C | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥H2S、SO2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
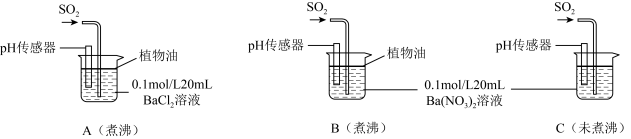
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
647次组卷
|
3卷引用:专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册
名校
8 . SO2 既有氧化性又有还原性,还有漂白性。下列对它变化中表现的性质标注正确的是
①SO2使溴水褪色(氧化性)
②SO2使品红溶液褪色(漂白性)
③SO2通入氢硫酸(H2S)产生淡黄色浑浊(还原性)
④SO2使润湿的蓝色石蕊试纸变红(水溶液酸性)
①SO2使溴水褪色(氧化性)
②SO2使品红溶液褪色(漂白性)
③SO2通入氢硫酸(H2S)产生淡黄色浑浊(还原性)
④SO2使润湿的蓝色石蕊试纸变红(水溶液酸性)
| A.只有②④ | B.只有③④ | C.只有①③ | D.①②③④ |
您最近一年使用:0次
2018-03-14更新
|
701次组卷
|
3卷引用:5.1.1 硫及其氧化物——同步学习必备知识
名校
9 . 实验室中为验证SO2的性质,将SO2分别通入溴水、品红溶液、硫化氢溶液、滴有酚酞的氢氧化钠溶液。下列说法错误的是
| A.溴水褪色,体现SO2的还原性 |
| B.品红溶液褪色,体现SO2的漂白性 |
| C.硫化氢溶液变浑浊,体现SO2的氧化性 |
| D.滴有酚酞的氢氧化钠溶液褪色,体现SO2的漂白性 |
您最近一年使用:0次
2024-02-25更新
|
1027次组卷
|
6卷引用:河北省唐山市2023-2024学年高一上学期1月期末考试化学试题
河北省唐山市2023-2024学年高一上学期1月期末考试化学试题河北省石家庄市第四十二中学2023-2024年高一上学期期末考试化学试题(已下线)专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)四川省德阳市什邡中学2023-2024学年高一下学期3月月考化学试题辽宁省沈阳铁路实验中学2023-2024学年高一下学期4月月考化学试题(已下线)专题01 硫、氮及其化合物 无机非金属材料-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
23-24高一·全国·假期作业
名校
10 . 下列关于SO2的说法中,不正确的是
| A.能使品红溶液褪色 |
| B.在空气中极易被O2氧化为SO3 |
| C.是酸性氧化物,能与水发生反应生成亚硫酸 |
| D.在有的反应中显示氧化性,有的反应中显示还原性 |
您最近一年使用:0次
2023-06-26更新
|
621次组卷
|
3卷引用:第14讲 硫和二氧化硫-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)
(已下线)第14讲 硫和二氧化硫-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)四川省泸县第五中学2022-2023学年高一下学期6月期末考试化学试题江西省萍乡市安源中学2022-2023学年高一下学期期中考试化学试题



