名校
1 . 下列离于反应方程式正确的是
A.铜与浓硫酸反应制取 : : |
B. 与稀硝酸反应制取 与稀硝酸反应制取 : : |
C.向 溶液中通入等物质的量的 溶液中通入等物质的量的 : :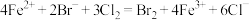 |
D. 与稀硫酸混合后溶液变浑浊: 与稀硫酸混合后溶液变浑浊: |
您最近一年使用:0次
2 . 某化学兴趣小组用如图装置制取 并完成相关性质探究。
并完成相关性质探究。
(1)装置A中发生反应的化学方程式为__________________ 。
(2)随着反应的进行,可观察到B试管中石蕊溶液变红,说明二氧化硫的水溶液呈_________ 性;可观察到D试管中的现象是__________________ 。
(3)E试管中 溶液的作用是
溶液的作用是__________________ 。
(4)为进一步探究 的漂白原理。利用反应产生的
的漂白原理。利用反应产生的 先通入品红的酒精溶液,再通入品红的水溶液。实验发现:品红的酒精溶液为红色,品红的水溶液褪色。根据实验观察到的现象,对漂白品红的粒子提出如下猜想:
先通入品红的酒精溶液,再通入品红的水溶液。实验发现:品红的酒精溶液为红色,品红的水溶液褪色。根据实验观察到的现象,对漂白品红的粒子提出如下猜想:
猜想1: ;猜想2:
;猜想2: ; 猜想3:
; 猜想3:_________ 。
针对猜想2设计简单实验,探究 的漂白原理:
的漂白原理:______________________ 。
 并完成相关性质探究。
并完成相关性质探究。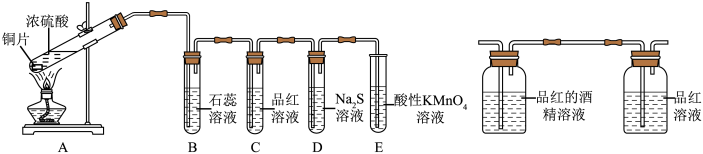
(1)装置A中发生反应的化学方程式为
(2)随着反应的进行,可观察到B试管中石蕊溶液变红,说明二氧化硫的水溶液呈
(3)E试管中
 溶液的作用是
溶液的作用是(4)为进一步探究
 的漂白原理。利用反应产生的
的漂白原理。利用反应产生的 先通入品红的酒精溶液,再通入品红的水溶液。实验发现:品红的酒精溶液为红色,品红的水溶液褪色。根据实验观察到的现象,对漂白品红的粒子提出如下猜想:
先通入品红的酒精溶液,再通入品红的水溶液。实验发现:品红的酒精溶液为红色,品红的水溶液褪色。根据实验观察到的现象,对漂白品红的粒子提出如下猜想:猜想1:
 ;猜想2:
;猜想2: ; 猜想3:
; 猜想3:针对猜想2设计简单实验,探究
 的漂白原理:
的漂白原理:
您最近一年使用:0次
2023-07-05更新
|
213次组卷
|
2卷引用:云南省曲靖市第二中学等三校联考2023-2024学年高一下学期3月月考化学试题
名校
解题方法
3 . 下列有关含硫物质转化判断正确的是
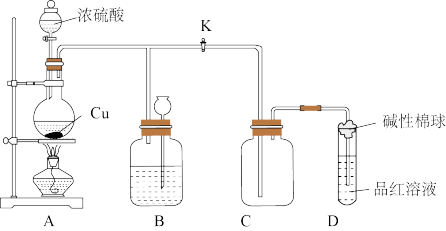

| A.0.1molCu与足量的硫充分反应,生成物的质量比该单质的质量增加了1.6g |
| B.如图是铜与浓硫酸反应的实验装置。B中盛装的是浓硫酸,作用是干燥SO2 |
| C.Cu投入稀硫酸中加热,没有明显变化,加入一定量的H2O2溶液,金属Cu逐渐溶解,反应中H2O2起催化作用 |
D.25.0mL0.100mol•L-1的Na2S2O3溶液恰好把224mL(标况)Cl2转化为Cl-,则S2O 将转化为S 将转化为S |
您最近一年使用:0次
2020-08-18更新
|
770次组卷
|
2卷引用:云南省玉溪市一中2020-2021学年高一下学期第一次月考化学试题
4 . 某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是_____ (填字母)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(2)将320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过________ (填操作名称)、干燥后,得到固体2.33 g,气体N与溴水反应的化学方程式为______________________ ,计算推知气体N中SO2的体积分数为________ 。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是________ ,理由是_______________________________ (用化学方程式表示)。
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是________________ (填字母) ,其中A的作用是_______________ ,B中试剂X的化学式是________ 。
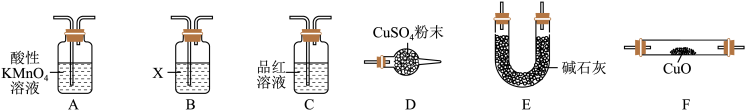
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(2)将320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是

您最近一年使用:0次
名校
5 . 某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________________ 。
(2)装置A的名称是________ ,装置B的作用是_________ ,装置D中所盛药品是__________ 。
(3)装置A中发生反应的化学方程式为____________________________ 。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________ 。
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________ ;不可直接向装置A中加水的原因是__________ 。

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是
(2)装置A的名称是
(3)装置A中发生反应的化学方程式为
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是
您最近一年使用:0次
2019-11-22更新
|
419次组卷
|
7卷引用:云南省红河州弥勒市2019-2020学年高二下学期期末考试化学试题
云南省红河州弥勒市2019-2020学年高二下学期期末考试化学试题福建省莆田市莆田第二十五中学2020届高三上学期期中考试化学试题(已下线)考点20 化学基础实验——《备战2020年高考精选考点专项突破题集》陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题九 化学实验 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第1讲 常用的仪器及基本操作
名校
6 . 将一定量的镁与100 mL 18.5 mol/L浓硫酸充分反应后,镁完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+) = 0.1 mol/L,则下列叙述中错误的是
| A.反应中共转移电子3 mol | B.反应中共消耗镁 36 g |
| C.气体A中SO2与H2的体积比为3:1 | D.气体A为SO2和H2的混合物 |
您最近一年使用:0次
2019-03-08更新
|
530次组卷
|
2卷引用:云南省红河哈尼族彝族自治州第一中学2023-2024学年高一下学期3月月考化学试题
7 . 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行以下探究活动:
【探究一】
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________________ 。
(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y。
①甲同学认为X中可能含有Fe3+和Fe2+。若要确认其中的Fe2+,应选用__________ (填序号)。
a.KSCN溶液 b.铁氰化钾溶液 c.盐酸
②乙同学取448mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为______________ ,充分反应后,加入足量BaC12溶液,经适当操作后得干燥固体2.33g。可推知气体Y中SO2的体积分数为__________ 。
【探究二】
据探究一所测SO2的体积分数,丙同学认为气体Y中可能还含有CO2和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究。
(3)装置A中的现象是_____________ ,其作用是________________ 。

(4)为判断CO2是否存在,需将装置M添加在______________ (填序号);
a.A之前 b.A~B之间 c.B-C之间 d.C~D之间
若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为__________ 。
(5)若C中固体变红,D中固体变蓝,则Q是___________ (填化学式),产生该气体的原因是__________ 。
(6)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为__________ (填序号)。
a.SO2 b.H2、SO2 c.H2、 CO2 d.CO2、SO2 e.CO2、SO2、H2
【探究一】
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y。
①甲同学认为X中可能含有Fe3+和Fe2+。若要确认其中的Fe2+,应选用
a.KSCN溶液 b.铁氰化钾溶液 c.盐酸
②乙同学取448mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为
【探究二】
据探究一所测SO2的体积分数,丙同学认为气体Y中可能还含有CO2和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究。
(3)装置A中的现象是

(4)为判断CO2是否存在,需将装置M添加在
a.A之前 b.A~B之间 c.B-C之间 d.C~D之间
若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为
(5)若C中固体变红,D中固体变蓝,则Q是
(6)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为
a.SO2 b.H2、SO2 c.H2、 CO2 d.CO2、SO2 e.CO2、SO2、H2
您最近一年使用:0次



