解题方法
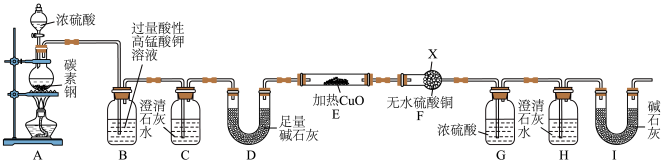
1 . 某化学学习小组为了探究铁质材料碳素钢(仅含有C和Fe)和浓硫酸反应的气体产物,利用下列装置(部分夹持仪器已省略)进行了如图实验探究活动:
(1)仪器X的名称为________ 。
(2)能证明生成 的实验现象为装置B中酸性高锰酸钾溶液
的实验现象为装置B中酸性高锰酸钾溶液________ ,说明 具有
具有________ 性,B中发生反应的离子方程式为________ 。
(3)实验过程中观察到E中黑色固体逐渐变红,F中无水硫酸铜由白色变成蓝色,原因是________ 。
(4)若装置C中澄清石灰水变浑浊,装置H中澄清石灰水未变浑浊,再结合(3)推知碳素钢与浓硫酸反应产生的气体中除了含有 外,还有
外,还有________ (填化学式);铁质材料中碳与浓硫酸反应的化学方程式为________ 。装置H后增加装置Ⅰ的目的是________ 。
(1)仪器X的名称为
(2)能证明生成
 的实验现象为装置B中酸性高锰酸钾溶液
的实验现象为装置B中酸性高锰酸钾溶液 具有
具有(3)实验过程中观察到E中黑色固体逐渐变红,F中无水硫酸铜由白色变成蓝色,原因是
(4)若装置C中澄清石灰水变浑浊,装置H中澄清石灰水未变浑浊,再结合(3)推知碳素钢与浓硫酸反应产生的气体中除了含有
 外,还有
外,还有
您最近一年使用:0次
2 . 浓硫酸、五氧化二磷都是常用的酸性干燥剂。某小组为了探究它们的干燥能力,设计如下实验(加热装置省略),实验中观察到B中白色粉末变蓝,D中产生白色沉淀,且品红溶液不褪色。回答下列问题:

部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
②Ba3(PO4)2为白色固体,难溶于水。
(1)仪器M的名称是___________ 。D中倒置漏斗的作用是___________ 。
(2)根据B中现象,可推断从A中逸出的物质含___________ (填化学式)。
(3)D中反应的离子方程式为___________ 。
(4)根据实验结果推知,五氧化二磷的干燥能力___________ (填“强于”、“弱于”或“等于”)98.3%硫酸。
(5)下列气体可以用98.3%硫酸干燥,也可以用五氧化二磷干燥的是___________ (填标号)。
a.硫化氢 b.氨气 c.二氧化氮 d.氯气
(6)加热A装置时温度不宜超过213℃,其原因是___________ 。

部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
| 98.3%硫酸 | 磷酸 | 三氧化硫 | |
| 熔点/℃ | 10.5 | 42 | 16.8 |
| 沸点/℃ | 338 | 213 | 44.8 |
(1)仪器M的名称是
(2)根据B中现象,可推断从A中逸出的物质含
(3)D中反应的离子方程式为
(4)根据实验结果推知,五氧化二磷的干燥能力
(5)下列气体可以用98.3%硫酸干燥,也可以用五氧化二磷干燥的是
a.硫化氢 b.氨气 c.二氧化氮 d.氯气
(6)加热A装置时温度不宜超过213℃,其原因是
您最近一年使用:0次
2023-08-31更新
|
198次组卷
|
5卷引用:陕西省部分学校2024届高三上学期8月入学考试化学试题
名校
解题方法
3 . 目前工业制备硫酸主要采用接触法,以黄铁矿( )为原料在沸腾炉制得
)为原料在沸腾炉制得 在经过氧化和和吸收获得硫酸。
在经过氧化和和吸收获得硫酸。
(1)请写出黄铁矿在沸腾炉里燃烧制得 的反应方程
的反应方程___________ ,若生成 气体标准状况下179.2L,则反应中转移的电子物质的量为
气体标准状况下179.2L,则反应中转移的电子物质的量为___________ 。
(2)某同学用如图装置(夹持装置略)探究铜丝与过量浓硫酸的反应,回答下列问题:

①铜与浓硫酸反应的化学方程式为___________ 。
②C中应加入的试剂为NaOH溶液,倒置漏斗的作用是___________ 。
③与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是:___________ 。
(3)油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量 )的侵蚀,生成PbS而变黑,可用一定量的
)的侵蚀,生成PbS而变黑,可用一定量的 溶液擦洗修复,
溶液擦洗修复, 与PbS反应生成
与PbS反应生成 的和
的和 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(4)硝酸是重要的化工原料,也是重要的氧化剂,将过量的铁投入到500mL的稀硝酸中,请写出对应的离子方程式___________ ,若生成标况下的气体为4.48L,则硝酸的物质的量浓度为___________ 。“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”,减少废气的排放是环境保护的重要内容之一,氮氧化物是形成光化学烟雾的主要元凶,利用碱液吸收法可以有效地吸收氮氧化物,发生的反应有 、
、
 ,若某混合气体中含a mol NO和b mol
,若某混合气体中含a mol NO和b mol  ,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为___________ 。
 )为原料在沸腾炉制得
)为原料在沸腾炉制得 在经过氧化和和吸收获得硫酸。
在经过氧化和和吸收获得硫酸。(1)请写出黄铁矿在沸腾炉里燃烧制得
 的反应方程
的反应方程 气体标准状况下179.2L,则反应中转移的电子物质的量为
气体标准状况下179.2L,则反应中转移的电子物质的量为(2)某同学用如图装置(夹持装置略)探究铜丝与过量浓硫酸的反应,回答下列问题:

①铜与浓硫酸反应的化学方程式为
②C中应加入的试剂为NaOH溶液,倒置漏斗的作用是
③与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是:
(3)油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量
 )的侵蚀,生成PbS而变黑,可用一定量的
)的侵蚀,生成PbS而变黑,可用一定量的 溶液擦洗修复,
溶液擦洗修复, 与PbS反应生成
与PbS反应生成 的和
的和 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)硝酸是重要的化工原料,也是重要的氧化剂,将过量的铁投入到500mL的稀硝酸中,请写出对应的离子方程式
 、
、
 ,若某混合气体中含a mol NO和b mol
,若某混合气体中含a mol NO和b mol  ,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
您最近一年使用:0次
名校
解题方法
4 . (1)在标准状况下进行甲、乙、丙三组实验。三组实验均各取60mL同浓度的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见下表:
甲、乙两组实验中,___________ (填“甲”或“乙”)组盐酸是不足量的,所用盐酸的物质的量浓度为___________ ,镁铝合金中Mg、Al物质的量之比为___________ 。
(2)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热(2NaHCO3 Na2CO3+CO2↑+H2O),将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g。则原混合物中碳酸钠的质量分数为
Na2CO3+CO2↑+H2O),将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g。则原混合物中碳酸钠的质量分数为___________ 。
(3)已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2。一定量的锌与100mL18.5mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体A 33.6L。将反应后的溶液稀释到1L,测得溶液中氢离子的浓度为0.1mol·L-1。写出锌跟浓硫酸反应的化学方程式:___________ 。反应过程中消耗的H2SO4的物质的量是___________ 。气体A的成分是___________ ,各成分的体积比是___________ 。反应过程中消耗的锌的质量是___________ 。
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(2)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热(2NaHCO3
 Na2CO3+CO2↑+H2O),将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g。则原混合物中碳酸钠的质量分数为
Na2CO3+CO2↑+H2O),将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g。则原混合物中碳酸钠的质量分数为(3)已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2。一定量的锌与100mL18.5mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体A 33.6L。将反应后的溶液稀释到1L,测得溶液中氢离子的浓度为0.1mol·L-1。写出锌跟浓硫酸反应的化学方程式:
您最近一年使用:0次
名校
5 . 某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________________ 。
(2)装置A的名称是________ ,装置B的作用是_________ ,装置D中所盛药品是__________ 。
(3)装置A中发生反应的化学方程式为____________________________ 。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________ 。
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________ ;不可直接向装置A中加水的原因是__________ 。

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是
(2)装置A的名称是
(3)装置A中发生反应的化学方程式为
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是
您最近一年使用:0次
2019-11-22更新
|
419次组卷
|
7卷引用:陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题
陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题福建省莆田市莆田第二十五中学2020届高三上学期期中考试化学试题(已下线)考点20 化学基础实验——《备战2020年高考精选考点专项突破题集》云南省红河州弥勒市2019-2020学年高二下学期期末考试化学试题宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题九 化学实验 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第1讲 常用的仪器及基本操作
6 . 中学化学中几种常见物质的转化关系如下:
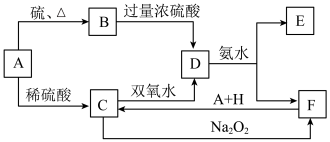
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:___________________________________ 。
(2)写出B的化学式:B________ 。
(3)①H2O2分子的电子式:__________________________________ 。
②写出C的酸性溶液与双氧水反应的离子方程式:_________________________ 。
(4)写出鉴定E中阳离子的实验方法和现象:____________________________ 。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:______________________________________________________ 。

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:
(2)写出B的化学式:B
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式:
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
您最近一年使用:0次
解题方法
7 . 非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:







(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________ ;
②在工业生产中B转化为C的化学方程式____________________________ 。
(2)若A在常温下为无色无味的气体,C是红棕色的气体。
①A、C的化学式分别是:A________ ;C________ 。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式___________________ 。







(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是
②在工业生产中B转化为C的化学方程式
(2)若A在常温下为无色无味的气体,C是红棕色的气体。
①A、C的化学式分别是:A
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
您最近一年使用:0次



