湖南省岳阳市湘阴县知源高级中学等学校联考2024届高三上学期第一次月考化学试题
湖南
高三
阶段练习
2023-09-29
110次
整体难度:
适中
考查范围:
认识化学科学、化学与STSE、物质结构与性质、有机化学基础、常见无机物及其应用、化学反应原理、化学实验基础
湖南省岳阳市湘阴县知源高级中学等学校联考2024届高三上学期第一次月考化学试题
湖南
高三
阶段练习
2023-09-29
110次
整体难度:
适中
考查范围:
认识化学科学、化学与STSE、物质结构与性质、有机化学基础、常见无机物及其应用、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
1. 东坡肉石(如图)是由碧石类矿物黄玉所雕,是清代雕刻代表作之一,其主要成分为 下列叙述错误的是
下列叙述错误的是

 下列叙述错误的是
下列叙述错误的是
| A.雕刻过程中只发生物理变化 | B.黄玉属于无机材料 |
| C.东坡肉石的主要成分中只含短周期元素 | D.可经常用氢氟酸溶液清洗东坡肉石 |
您最近一年使用:0次
2023-08-31更新
|
132次组卷
|
4卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
2. 管道工人用浓氨水检验氯气管道是否漏气。已知反应原理为 。下列有关化学用语的表示错误的是
。下列有关化学用语的表示错误的是
 。下列有关化学用语的表示错误的是
。下列有关化学用语的表示错误的是A.NH3分子的空间填充模型: | B.铵根离子的电子式: |
C.氮气的结构式: | D.中子数为18的氯原子: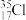 |
您最近一年使用:0次
2023-08-31更新
|
139次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
3. 下列关于 的说法错误的是
的说法错误的是
 的说法错误的是
的说法错误的是| A.含有3种官能团 |
| B.能使酸性高锰酸钾溶液褪色 |
| C.分子中所有碳原子可能处于同一平面上 |
| D.在一定条件下能发生水解反应和加成反应 |
【知识点】 有机反应类型 同分异构体的数目的确定解读 苯分子结构的特点解读
您最近一年使用:0次
2023-08-31更新
|
107次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
名校
4. 下列化学事实不符合“事物发展遵循主要矛盾和次要矛盾辨证统一”的哲学原理的是
| A.钠、锂分别在氧气中燃烧生成Na2O2、Li2O |
| B.在锌一铜稀硫酸原电池中铜极产生大量气泡,锌极产生微量气泡 |
| C.在Na2SO3和Na2S的混合液中滴加盐酸,产生大量沉淀和少量气体 |
| D.煮沸含Ca(HCO3)2、Mg(HCO3)2的自来水,生成CaCO3和Mg(OH)2 |
【知识点】 离子反应的发生及书写 过氧化钠 盐类水解的应用 原电池
您最近一年使用:0次
2023-08-31更新
|
249次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
5. Robert O。Ritchie团队在Science杂志发表论文,报道了一种由铬、钴和镍组成的三元高熵合金(CrCoNi),这种金属材料不但具有极高的延展性和强度,而且其低温(20K)断裂韧性更打破了迄今为止的记录。下列叙述正确的是
| A.CrCoNi的熔点高于Ni的熔点 |
| B.上述三种金属元素都位于元素周期表d区 |
| C.上述合金的机械强度低于组成合金的金属 |
| D.上述金属的基态原子中,未成对电子数最多的是Ni |
您最近一年使用:0次
2023-08-31更新
|
81次组卷
|
4卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
解题方法
6. 一定条件下,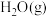 在某催化剂表面上发生分解反应生成
在某催化剂表面上发生分解反应生成 和
和 ,测得的实验结果如图所示。下列叙述正确的是
,测得的实验结果如图所示。下列叙述正确的是

已知:化学上,将反应物消耗一半所用的时间称为半衰期 。
。
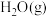 在某催化剂表面上发生分解反应生成
在某催化剂表面上发生分解反应生成 和
和 ,测得的实验结果如图所示。下列叙述正确的是
,测得的实验结果如图所示。下列叙述正确的是
已知:化学上,将反应物消耗一半所用的时间称为半衰期
 。
。A.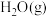 在该催化剂表面的分解反应是可逆反应 在该催化剂表面的分解反应是可逆反应 |
B.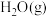 的半衰期与起始浓度成反比 的半衰期与起始浓度成反比 |
C.在该催化剂表面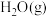 分解反应先快后慢 分解反应先快后慢 |
D.ab段O2(g)的平均生成速率为 |
您最近一年使用:0次
2023-09-03更新
|
71次组卷
|
2卷引用:湖南省岳阳市湘阴县知源高级中学等学校联考2024届高三上学期第一次月考化学试题
单选题
|
适中(0.65)
解题方法
7. CaO2常用作长途运输海鲜产品的供氧剂,性质与过氧化钠相似。选用如图部分装置合理组装可用于制备CaO2.下列叙述错误的是


| A.①中MnO2作双氧水分解反应的催化剂 |
| B.③用于干燥氧气时,可用装碱石灰的U形管代替 |
| C.气流从左至右,导管接口连接顺序为aedbcf |
| D.②中转移0.2mol电子时,生成7.2gCaO2 |
您最近一年使用:0次
2023-08-31更新
|
209次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
8. 复旦大学一课题组首次实现了以(杂)芳基磺酰氯(ArSO2Cl)为引发剂的有机催化光调控活性聚合(如图)。图中R、R'为烷基,Ar为芳基。下列述错误的是


| A.X能发生氧化反应和加聚反应 | B.Y遇水能发生取代反应生成ArSO3H |
| C.M分子中C原子、N原子均只采用sp2杂化 | D.Z是线型高分子材料,具有热塑性 |
您最近一年使用:0次
2023-08-31更新
|
76次组卷
|
4卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
解题方法
9. 前三周期主族元素X、Y、Z、R的原子序数依次增大,X是地壳中含量最高的元素,Y的p轨道电子总数比s轨道电子总数多1且p轨道有一个未成对电子,X的最外层电子数为Z的最外层电子数的三倍,Z、R、X的最外层电子数呈等差数列。下列叙述错误的是
| A.原子半径:Z>R>X>Y | B.RY4分子具有正四面体结构 |
| C.与氢形成的共价键键能:H−X>H−Y | D.Z与Y形成的化合物为离子化合物 |
您最近一年使用:0次
2023-08-31更新
|
81次组卷
|
4卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
解题方法
10. 下列离子方程式正确的是
A.在含Ca(OH)2和Mg(OH)2的浊液中加入饱和MgCl2溶液: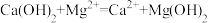 |
B.在烧碱溶液中滴加少量明矾溶液: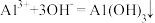 |
C.将NaHSO4溶液和NaHSO3溶液混合: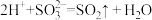 |
D.在氨水中加入少量CuSO4溶液: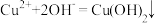 |
您最近一年使用:0次
2023-08-31更新
|
119次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
较难(0.4)
解题方法
11. 锂与生活息息相关,个人携带的笔记本电脑、手机、蓝牙耳机等数码产品中应用的锂离子电池中就含有丰富的锂元素。锂晶胞为最密六方堆积(如图),图中底边长为apm,高为bpm,设NA为阿伏加德罗常数的值,下列说法错误的是


| A.该结构中含有6个Li原子 |
| B.该结构中Li的配位数为6 |
C.锂晶体的密度为 |
| D.锂离子电池放电时,Li+从负极脱嵌,经过电解质嵌入正极 |
您最近一年使用:0次
2023-08-31更新
|
297次组卷
|
4卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
解题方法
12. 科学家设计了一种光电化学电池,利用光催化BiVO4负极氧化烯烃制备环氧化物,同时有氢气生成,装置如图所示。下列叙述错误的是


| A.NaBr只起导电作用,其浓度基本保持不变(不考虑溴挥发) |
B.BiVO4极的电极反应式为 |
| C.铂极上产生11.2L氢气(标准状况)时,理论上转移1mol电子 |
D.总反应为   +H2↑ +H2↑ |
您最近一年使用:0次
2023-08-31更新
|
157次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
13. 山东大学材料科学与工程学院开发催化剂用于光热催化CO2加氢制CH4.反应历程如图所示(*表示吸附在催化剂表面)。已知:CH4的选择性等于平衡时CH4的物质的量与CO2转化的物质的量之比。下列叙述正确的是


A.*CO→CO(g) 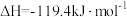 |
| B.升高温度,CH4的选择性增大,CO、*CH3OH的选择性减小 |
| C.CO2制*CH3OH的历程中,*HCO3→*HCOO的能垒最大 |
| D.在上述条件下,稳定性:CH4(g)>CO(g) |
您最近一年使用:0次
2023-08-31更新
|
219次组卷
|
4卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
单选题
|
较难(0.4)
14. 某小组为了探究NaHSO3和Na2SO3溶液的相关性质,进行如下实验:
实验1:常温下,用pH计测得0.1mol·L-1NaHCO3溶液的pH为9.7,向溶液中缓慢通入SO2,使溶质恰好变为NaHSO3(忽略溶液体积变化),测得溶液的pH为5.28。
实验2:取10mL0.1mol·L-1Na2SO3溶液,先加热,后降温,测得溶液pH与温度的关系如图所示(忽略溶液体积变化)。下列叙述正确的是

实验1:常温下,用pH计测得0.1mol·L-1NaHCO3溶液的pH为9.7,向溶液中缓慢通入SO2,使溶质恰好变为NaHSO3(忽略溶液体积变化),测得溶液的pH为5.28。
实验2:取10mL0.1mol·L-1Na2SO3溶液,先加热,后降温,测得溶液pH与温度的关系如图所示(忽略溶液体积变化)。下列叙述正确的是

A.常温下 |
B.常温下, |
C.a→b→c,主要原因是升高温度抑制 水解,促进水电离 水解,促进水电离 |
D.c→d,主要原因是降低温度使 减小 减小 |
您最近一年使用:0次
2023-08-31更新
|
255次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
解题方法
15. 浓硫酸、五氧化二磷都是常用的酸性干燥剂。某小组为了探究它们的干燥能力,设计如下实验(加热装置省略),实验中观察到B中白色粉末变蓝,D中产生白色沉淀,且品红溶液不褪色。回答下列问题:

部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
②Ba3(PO4)2为白色固体,难溶于水。
(1)仪器M的名称是___________ 。D中倒置漏斗的作用是___________ 。
(2)根据B中现象,可推断从A中逸出的物质含___________ (填化学式)。
(3)D中反应的离子方程式为___________ 。
(4)根据实验结果推知,五氧化二磷的干燥能力___________ (填“强于”、“弱于”或“等于”)98.3%硫酸。
(5)下列气体可以用98.3%硫酸干燥,也可以用五氧化二磷干燥的是___________ (填标号)。
a.硫化氢 b.氨气 c.二氧化氮 d.氯气
(6)加热A装置时温度不宜超过213℃,其原因是___________ 。

部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
| 98.3%硫酸 | 磷酸 | 三氧化硫 | |
| 熔点/℃ | 10.5 | 42 | 16.8 |
| 沸点/℃ | 338 | 213 | 44.8 |
(1)仪器M的名称是
(2)根据B中现象,可推断从A中逸出的物质含
(3)D中反应的离子方程式为
(4)根据实验结果推知,五氧化二磷的干燥能力
(5)下列气体可以用98.3%硫酸干燥,也可以用五氧化二磷干燥的是
a.硫化氢 b.氨气 c.二氧化氮 d.氯气
(6)加热A装置时温度不宜超过213℃,其原因是
您最近一年使用:0次
2023-08-31更新
|
198次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
解答题-工业流程题
|
适中(0.65)
16. 硫酸铈铵[(NH4)4Ce(SO4)4]是分析化学常用的滴定剂。以氟碳铈矿(含CeFCO3、BaF2、SiO2等)为原料制备硫酸铈铵的工艺流程如图所示。

已知部分信息如下:
①Ce3+在空气中易被氧化为Ce4+。
②“沉铈”时发生的反应之一: 。
。
回答下列问题:
(1) CeFCO3中电负性最大的是___________ (填元素符号),画出H2O的VSEPR模型:___________ 。
(2)“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是___________ 。
(3)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是___________ 。

(4)“沉铈”时,硫脲作___________ (填“还原剂”或“氧化剂”)。
(5)“溶解”时,为防止 被氧化,可以加入
被氧化,可以加入___________ (填标号)。
a.KMnO4 b.NaClO c.CH3CHO
(6)在有机合成中,硫酸铈铵常作合成丙酸异戊酯的催化剂、其他条件相同,酯产率与催化剂质量的关系如图3所示。工业生产中,选择的最佳催化剂质量为___________

(7)测定产品纯度。称取w g产品溶于水,配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶中。加入 溶液,恰好完全反应。该产品纯度为
溶液,恰好完全反应。该产品纯度为___________ %。(杂质不参与反应,滴定反应为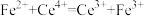 )
)

已知部分信息如下:
①Ce3+在空气中易被氧化为Ce4+。
②“沉铈”时发生的反应之一:
 。
。回答下列问题:
(1) CeFCO3中电负性最大的是
(2)“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是
(3)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是

(4)“沉铈”时,硫脲作
(5)“溶解”时,为防止
 被氧化,可以加入
被氧化,可以加入a.KMnO4 b.NaClO c.CH3CHO
(6)在有机合成中,硫酸铈铵常作合成丙酸异戊酯的催化剂、其他条件相同,酯产率与催化剂质量的关系如图3所示。工业生产中,选择的最佳催化剂质量为

(7)测定产品纯度。称取w g产品溶于水,配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶中。加入
 溶液,恰好完全反应。该产品纯度为
溶液,恰好完全反应。该产品纯度为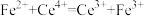 )
)
您最近一年使用:0次
2023-09-03更新
|
71次组卷
|
2卷引用:湖南省岳阳市湘阴县知源高级中学等学校联考2024届高三上学期第一次月考化学试题
解答题-原理综合题
|
适中(0.65)
17. (NH4)Fe3(SO4)2(OH)6常作净水剂。它失重过程发生的反应如下:
①

②

③
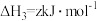
(1)(NH4)Fe3(SO4)2(OH)6净水时___________ (填“有”或“没有”)发生氧化还原反应。
(2)反应 的△H=
的△H=___________ kJ·mo1-1。
(3)一定温度下,在恒容密闭容器中加入一定量的(NH4)Fe3(SO4)2(OH)6(s),只发生反应: ,下列情况表明该反应达到平衡状态的是___________(填标号)。
,下列情况表明该反应达到平衡状态的是___________(填标号)。
(4)500℃时,在体积可变的密闭容器中加入一定量的(NH4)Fe3(SO4)2(OH)6固体,只发生反应: ,达到平衡时测得
,达到平衡时测得 。保持温度不变,将容器体积变为原来的一半,达到新平衡时c(H2O)=
。保持温度不变,将容器体积变为原来的一半,达到新平衡时c(H2O)=___________ mol·L-1。
(5)一定温度下,总压强恒定为8ρkPa时,向体积可变的密闭目容器中加入一定量的2Fe2O3·Fe2(SO4)3·(NH4)2SO4(s)和nmol氩气,仅发生反应②。测得平衡状态下n(NH3)与n(Ar)的关系如图所示。随着通入Ar的量增大,NH3的量增大的原因是___________ 。n(Ar)为0.1mol时压强平衡常数Kp=___________ 。

提示:用分压计算的平衡常数为KP,分压=总压X气体物质的量分数。
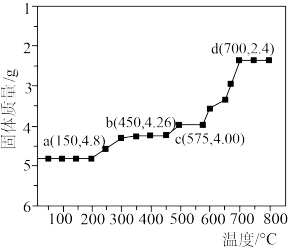
(6)(NH4)Fe3(SO4)2(OH)6失重时固体质量与温度的关系如图所示(变化过程中铁元素化合价不变)。a→b过程只失去一种气体,该气体是___________ (填化学式),d点对应固体的物质的量为___________ 。
①


②


③

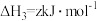
(1)(NH4)Fe3(SO4)2(OH)6净水时
(2)反应
 的△H=
的△H=(3)一定温度下,在恒容密闭容器中加入一定量的(NH4)Fe3(SO4)2(OH)6(s),只发生反应:
 ,下列情况表明该反应达到平衡状态的是___________(填标号)。
,下列情况表明该反应达到平衡状态的是___________(填标号)。| A.混合气体密度不随时间变化 | B.SO3体积分数不随时间变化 |
| C.气体平均摩尔质量不随时间变化 | D.Fe2O3质量不随时间变化 |
 ,达到平衡时测得
,达到平衡时测得 。保持温度不变,将容器体积变为原来的一半,达到新平衡时c(H2O)=
。保持温度不变,将容器体积变为原来的一半,达到新平衡时c(H2O)=(5)一定温度下,总压强恒定为8ρkPa时,向体积可变的密闭目容器中加入一定量的2Fe2O3·Fe2(SO4)3·(NH4)2SO4(s)和nmol氩气,仅发生反应②。测得平衡状态下n(NH3)与n(Ar)的关系如图所示。随着通入Ar的量增大,NH3的量增大的原因是

提示:用分压计算的平衡常数为KP,分压=总压X气体物质的量分数。
(6)(NH4)Fe3(SO4)2(OH)6失重时固体质量与温度的关系如图所示(变化过程中铁元素化合价不变)。a→b过程只失去一种气体,该气体是

您最近一年使用:0次
2023-09-26更新
|
141次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
解答题-有机推断题
|
较难(0.4)
解题方法
18. 南京邮电大学一课题组合成一种具有自修复功能的新型聚合物电解质G,一种G的合成流程如图所示。回答下列问题:

(1)A中官能团的名称是___________ 。A→B的反应类型是___________ 。
(2)溴乙烷难溶于水,而C(2−溴乙醇)能与水互溶,其原因是___________ 。
(3)写出B→D的化学方程式:___________ 。
(4)已知:吡啶的结构简式为 ,具有芳香性和弱碱性。在B→D中,吡啶的作用是
,具有芳香性和弱碱性。在B→D中,吡啶的作用是___________ 。
(5)A→B的另一产物可能是___________ (填标号)。
a.SO3 b.H2SO3 c.SO(OH)Cl d.SO3和HCl
(6)T是A的同分异构体,T同时具备下列条件的结构有___________ 种(不包括立体异构)。
①能发生银镜反应;②与钠反应生成H2;③羟基连接在双键的碳原子上的结构不稳定
ⅰ.其中,在核磁共振氢谱上有3组峰且峰的面积比为1:1:4的结构简式为___________ 。
ⅱ.含手性碳原子的结构简式为___________ 。

(1)A中官能团的名称是
(2)溴乙烷难溶于水,而C(2−溴乙醇)能与水互溶,其原因是
(3)写出B→D的化学方程式:
(4)已知:吡啶的结构简式为
 ,具有芳香性和弱碱性。在B→D中,吡啶的作用是
,具有芳香性和弱碱性。在B→D中,吡啶的作用是(5)A→B的另一产物可能是
a.SO3 b.H2SO3 c.SO(OH)Cl d.SO3和HCl
(6)T是A的同分异构体,T同时具备下列条件的结构有
①能发生银镜反应;②与钠反应生成H2;③羟基连接在双键的碳原子上的结构不稳定
ⅰ.其中,在核磁共振氢谱上有3组峰且峰的面积比为1:1:4的结构简式为
ⅱ.含手性碳原子的结构简式为
您最近一年使用:0次
2023-08-31更新
|
80次组卷
|
5卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、化学与STSE、物质结构与性质、有机化学基础、常见无机物及其应用、化学反应原理、化学实验基础
试卷题型(共 18题)
题型
数量
单选题
14
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 物理变化与化学变化 传统硅酸盐材料 新型无机非金属材料 | |
| 2 | 0.65 | 有机物的结构式、结构简式、比例模型、球棍模型、最简式 共价型分子结构式、电子式 原子、离子、原子团及其电子式的书写与判断 原子中相关数值及其之间的相互关系 | |
| 3 | 0.65 | 有机反应类型 同分异构体的数目的确定 苯分子结构的特点 | |
| 4 | 0.65 | 离子反应的发生及书写 过氧化钠 盐类水解的应用 原电池 | |
| 5 | 0.65 | 元素性质与电负性的关系 氢键对物质性质的影响 晶体的类型与物质熔点、硬度、导电性的关系 | |
| 6 | 0.65 | 化学反应速率计算 可逆反应及反应限度 | |
| 7 | 0.65 | 氧化还原反应有关计算 常用仪器及使用 常见气体的制备与收集 物质制备的探究 | |
| 8 | 0.65 | 含碳碳双键物质的性质的推断 利用杂化轨道理论判断化学键杂化类型 | |
| 9 | 0.65 | 微粒半径大小的比较方法 根据原子结构进行元素种类推断 电子排布式 价层电子对互斥理论的应用 | |
| 10 | 0.65 | 铝盐与强碱溶液反应 沉淀转化 | |
| 11 | 0.4 | 原电池原理的综合应用 简单配合物的成键 晶胞的有关计算 | |
| 12 | 0.65 | 原电池原理理解 原电池电极反应式书写 原电池有关计算 | |
| 13 | 0.65 | 化学能与物质稳定性之间的关系 吸热反应和放热反应 活化能及其对反应速率的影响 催化剂对化学反应速率的影响 | |
| 14 | 0.4 | 弱电解质的电离平衡 电离平衡常数及影响因素 盐类水解规律理解及应用 | |
| 二、解答题 | |||
| 15 | 0.4 | 离子方程式的书写 浓硫酸的强氧化性 化学实验基础操作 物质性质的探究 | 实验探究题 |
| 16 | 0.65 | 氧化还原反应的几组概念 酸碱中和滴定原理的应用 元素性质与电负性的关系 常见无机物的制备 | 工业流程题 |
| 17 | 0.65 | 盖斯定律及其有关计算 化学平衡的有关计算 化学平衡状态的判断方法 化学平衡常数的有关计算 | 原理综合题 |
| 18 | 0.4 | 有机反应类型 根据要求书写同分异构体 同分异构体的数目的确定 有机推断综合考查 | 有机推断题 |



