名校
解题方法
1 . 如图所示,实验室中利用洁净的铜片(0.3 mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到Cu2S和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。下列说法错误的是
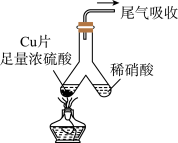

| A.白色固体为CuSO4 |
| B.NO为还原产物,b为氧化产物 |
| C.NO与b的物质的量之和可能为0.2 mol |
| D.参加反应的浓硫酸中,表现氧化性的占25% |
您最近半年使用:0次
2023-05-16更新
|
1165次组卷
|
3卷引用:山东省烟台市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
2 . 已知Na2SO3 +S= Na2S2O3,实验室用下述方法制备 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是
 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是A.①中消耗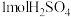 转移 转移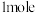 |
| B.②中溶液先变浑浊的原因:2Na2S+3SO2= 2Na2SO3+3S↓ |
C.为提高产品的纯度,混合液中 的最佳比例为1∶2 的最佳比例为1∶2 |
D.用适量 溶液吸收②中逸出的 溶液吸收②中逸出的 、 、 气体,吸收液可直接返回到步骤② 气体,吸收液可直接返回到步骤② |
您最近半年使用:0次
2023-01-14更新
|
2837次组卷
|
9卷引用:山东省烟台市2022-2023学年高三上学期期末学业水平诊断化学试题
3 . 化学小组实验探究 与
与 溶液的反应。
溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
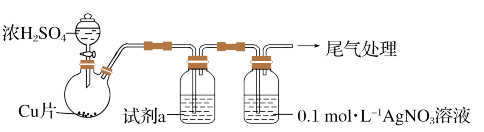
①浓 与
与 反应体现了浓硫酸的性质是
反应体现了浓硫酸的性质是___________ 。
②试剂a为饱和的亚硫酸氢钠溶液,其作用是___________ 。
(2) 实验二:验证B的成分。对体系中有关物质性质分析得出:沉淀B可能为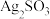 、
、 或二者混合物。(资料:
或二者混合物。(资料: 微溶于水;
微溶于水;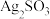 难溶于水;二均易溶于氨水,形成难电离的银氨离子:
难溶于水;二均易溶于氨水,形成难电离的银氨离子: ,且其离子化合物易溶于水)
,且其离子化合物易溶于水)

①写出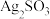 溶于氨水的离子方程式:
溶于氨水的离子方程式:___________ 。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F.推断D中主要是 ,进而推断B中含有
,进而推断B中含有___________ 。向滤液E中加入双氧水试剂,可进一步证实B中含有该物质,加入试剂后有关反应的离子方程式为___________ 。
(3)根据沉淀F的存在,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验一中, 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。
途径2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
实验三:探究 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有 ;取上层清液继续滴加
;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含
溶液,未出现白色沉淀,可判断B中不含 。
。
②实验三的结论:___________ 。
(4)实验室中,下列化学试剂可用于吸收尾气中含有 的是
的是___________ 。
A. 溶液 B.浓硫酸 C.酸性
溶液 B.浓硫酸 C.酸性 溶液 D.
溶液 D. 溶液 E.
溶液 E. 溶液
溶液
 与
与 溶液的反应。
溶液的反应。(1)实验一:用如下装置(夹持、加热仪器略)制备
 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
①浓
 与
与 反应体现了浓硫酸的性质是
反应体现了浓硫酸的性质是②试剂a为饱和的亚硫酸氢钠溶液,其作用是
(2) 实验二:验证B的成分。对体系中有关物质性质分析得出:沉淀B可能为
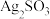 、
、 或二者混合物。(资料:
或二者混合物。(资料: 微溶于水;
微溶于水;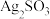 难溶于水;二均易溶于氨水,形成难电离的银氨离子:
难溶于水;二均易溶于氨水,形成难电离的银氨离子: ,且其离子化合物易溶于水)
,且其离子化合物易溶于水)
①写出
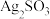 溶于氨水的离子方程式:
溶于氨水的离子方程式:②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F.推断D中主要是
 ,进而推断B中含有
,进而推断B中含有(3)根据沉淀F的存在,推测
 的产生有两个途径:
的产生有两个途径:途径1:实验一中,
 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。途径2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。实验三:探究
 的产生途径
的产生途径①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有
 ;取上层清液继续滴加
;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含
溶液,未出现白色沉淀,可判断B中不含 。
。②实验三的结论:
(4)实验室中,下列化学试剂可用于吸收尾气中含有
 的是
的是A.
 溶液 B.浓硫酸 C.酸性
溶液 B.浓硫酸 C.酸性 溶液 D.
溶液 D. 溶液 E.
溶液 E. 溶液
溶液
您最近半年使用:0次
2022-09-19更新
|
648次组卷
|
2卷引用:湖北省云学新高考联盟学校2022-2023学年高二上学期9月考试化学试题
4 . 某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设]假设1:气体产物只有SO2;假设2:_______________ 。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
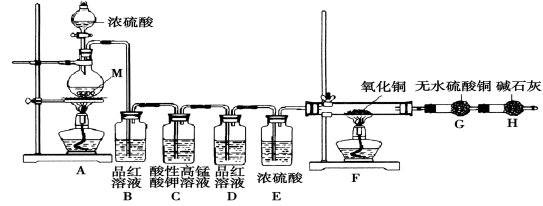
(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后_________________________ ,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式:______________________ ;
(3)若假设2正确,则可观察到:F管中_____________ ;G干燥管里______________ 。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法:________ 。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为__________ 。试写出烧瓶里发生反应的总化学方程式____________________ 。
[提出假设]假设1:气体产物只有SO2;假设2:
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。

(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式:
(3)若假设2正确,则可观察到:F管中
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法:
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为
您最近半年使用:0次
2016-12-09更新
|
983次组卷
|
3卷引用:2015届山东省济宁市泗水县第一中学高三4月模拟化学试卷
5 . 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
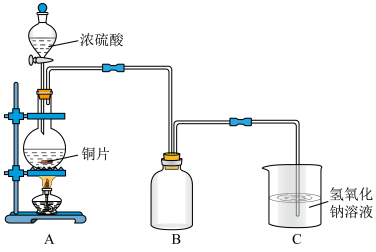
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整_________________________ 。
(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:__________________
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:____________________
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:_________________
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:
先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是__________ (填写字母编号)。其中计算结果余酸物质的量浓度比实际偏高的是_______________ (填写字母编号)
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)若A项不可行,请写出改进的方法:___________________ (若A项可行则该空写“不用改进”)

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整
(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:
先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是_
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)若A项不可行,请写出改进的方法:
您最近半年使用:0次
2016-12-09更新
|
573次组卷
|
2卷引用:2014-2015浙江省杭州地区重点中学高一上学期期末联考化学试卷



