1 . 碘化钾可用于制备有机化合物和化学试剂,也用作照相感光乳化剂及某些难溶金属碘化物的助溶剂。某探究实验小组在实验室设计制备一定量KI的实验(加热及夹持装置已省略)如图所示:

请回答下列问题:
(1)实验开始前,先按上述装置图连接装置,然后进行的操作为___________ ;实验开始时,应先打开分液漏斗___________ (填“a”或“b”)使之反应。
(2)装置A中发生反应的离子方程式为___________ ,___________ (填“能”或“不能”)用稀硝酸代替稀硫酸。
(3)仪器c的名称是___________ ,装置B中发生反应的化学方程式为___________ 。
(4)装置C的作用为___________ 。
(5)为了探究KI的性质,该探究实验小组利用氧化还原反应原理设计如图所示实验。

接通灵敏电流计后,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着反应的进行,灵敏电流计读数逐渐变小,最后读数变为零,需向D中加入少量___________ (填化学式)固体或向E中加入少量___________ (填化学式)固体,若灵敏电流计出现指针偏向右侧,测证明该反应为___________ (填“可逆”或“不可逆”)反应,其反应的离子方程式为___________ 。

请回答下列问题:
(1)实验开始前,先按上述装置图连接装置,然后进行的操作为
(2)装置A中发生反应的离子方程式为
(3)仪器c的名称是
(4)装置C的作用为
(5)为了探究KI的性质,该探究实验小组利用氧化还原反应原理设计如图所示实验。

接通灵敏电流计后,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着反应的进行,灵敏电流计读数逐渐变小,最后读数变为零,需向D中加入少量
您最近一年使用:0次
名校
解题方法
2 . 固体化合物 由3种元素组成,某学习小组开展如下探究实验。
由3种元素组成,某学习小组开展如下探究实验。

物质 的摩尔质量为
的摩尔质量为 。溶液
。溶液 是单一的正盐溶液。混合气体
是单一的正盐溶液。混合气体 能使品红溶液褪色。请回答:
能使品红溶液褪色。请回答:
(1)组成 的三种元素为
的三种元素为___________ ; 的化学式为
的化学式为___________ 。
(2)混合气体 的组成为
的组成为___________ (用化学式表示)。
(3)①写出固体 与过量稀硫酸在加热条件下反应的离子方程式(非氧化还原反应)
与过量稀硫酸在加热条件下反应的离子方程式(非氧化还原反应)___________ 。
②C能与足量的烧碱溶液反应,写出该反应的化学方程式___________ 。
(4)设计实验,检验混合物中的B___________ 。
 由3种元素组成,某学习小组开展如下探究实验。
由3种元素组成,某学习小组开展如下探究实验。
物质
 的摩尔质量为
的摩尔质量为 。溶液
。溶液 是单一的正盐溶液。混合气体
是单一的正盐溶液。混合气体 能使品红溶液褪色。请回答:
能使品红溶液褪色。请回答:(1)组成
 的三种元素为
的三种元素为 的化学式为
的化学式为(2)混合气体
 的组成为
的组成为(3)①写出固体
 与过量稀硫酸在加热条件下反应的离子方程式(非氧化还原反应)
与过量稀硫酸在加热条件下反应的离子方程式(非氧化还原反应)②C能与足量的烧碱溶液反应,写出该反应的化学方程式
(4)设计实验,检验混合物中的B
您最近一年使用:0次
名校
解题方法
3 . 化合物 是一种由三种元素组成的重要化工原料,其
是一种由三种元素组成的重要化工原料,其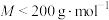 ,进行如图所示操作,已知
,进行如图所示操作,已知 、
、 含有一种相同的元素且在常温下均为气态化合物,其中气体
含有一种相同的元素且在常温下均为气态化合物,其中气体 可使品红溶液褪色(部分反应条件省略)。请回答:
可使品红溶液褪色(部分反应条件省略)。请回答:
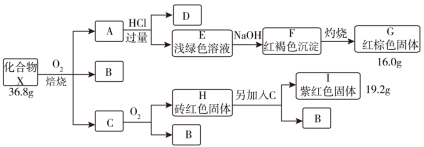
(1)组成 的元素有
的元素有___________ ,化合物 的化学式是
的化学式是___________ 。
(2)溶液 中溶质的主要成分是
中溶质的主要成分是___________ (用化学式表示)。
(3)写出 与
与 反应生成
反应生成 、
、 、
、 的化学方程式:
的化学方程式:___________ 。
(4)写出 与
与 反应生成
反应生成 和
和 的化学方程式:
的化学方程式:___________ 。
(5)请设计实验确定气体 的成分:
的成分:___________ 。
 是一种由三种元素组成的重要化工原料,其
是一种由三种元素组成的重要化工原料,其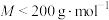 ,进行如图所示操作,已知
,进行如图所示操作,已知 、
、 含有一种相同的元素且在常温下均为气态化合物,其中气体
含有一种相同的元素且在常温下均为气态化合物,其中气体 可使品红溶液褪色(部分反应条件省略)。请回答:
可使品红溶液褪色(部分反应条件省略)。请回答:
(1)组成
 的元素有
的元素有 的化学式是
的化学式是(2)溶液
 中溶质的主要成分是
中溶质的主要成分是(3)写出
 与
与 反应生成
反应生成 、
、 、
、 的化学方程式:
的化学方程式:(4)写出
 与
与 反应生成
反应生成 和
和 的化学方程式:
的化学方程式:(5)请设计实验确定气体
 的成分:
的成分:
您最近一年使用:0次
2022-12-28更新
|
598次组卷
|
4卷引用:浙江省金华十校2021-2022学年高三下学期4月模拟考试化学试题
浙江省金华十校2021-2022学年高三下学期4月模拟考试化学试题(已下线)化学预测卷(六)-预测卷(浙江专版)(已下线)2023年1月浙江省普通高校招生选考变式题(无机推断题)湖北省武昌实验中学2022-2023学年高一下学期3月月考化学试题
解题方法
4 .  和
和 都是重要的含硫兴趣小组对两者的性质进行了以下探究。
都是重要的含硫兴趣小组对两者的性质进行了以下探究。
I.探究 的性质
的性质
该组同学根据 设计制备
设计制备 ,并进行性质探究,装置如下图:
,并进行性质探究,装置如下图:

回答下列问题:
(1)装置I方框内最合适的装置为_______(填标号)。
(2)滴加硫酸开始反应,按要求填写下列表格。
II.探究 的性质
的性质
在下图装置中先后四次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致、打开开关K,通入 流速一致。四次实验现象如下表:
流速一致。四次实验现象如下表:

分别得到如下pH-t图:

(3)A装置中覆盖食用油的目的是_______ 。
(4)pH-t图中,曲线①呈缓慢下降趋势,这是因为_______ ;曲线②出现骤降,这是因为_______ 。
(5)对比分析上述四组数据,可得出的结论是_______ (任写2条)
 和
和 都是重要的含硫兴趣小组对两者的性质进行了以下探究。
都是重要的含硫兴趣小组对两者的性质进行了以下探究。I.探究
 的性质
的性质该组同学根据
 设计制备
设计制备 ,并进行性质探究,装置如下图:
,并进行性质探究,装置如下图:
回答下列问题:
(1)装置I方框内最合适的装置为_______(填标号)。
A. | B. | C. | D. |
| 装置 | 装置中的试剂 | 实验预期现象 | 相关的离子方程式 |
| I |  和FeS 和FeS | 黑色固体溶解,有气泡产生 | 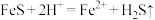 |
| II |  溶液 溶液 | 有黑色沉淀产生 | ① |
| III | 双氧水 | ② | ③ |
| IV | ④ | 气体被吸收 | ⑤ |
II.探究
 的性质
的性质在下图装置中先后四次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致、打开开关K,通入
 流速一致。四次实验现象如下表:
流速一致。四次实验现象如下表:| ① | ② | ③ | ④ |
已煮沸的 溶液 溶液 | 未煮沸的 溶液 溶液 | 已煮沸的 溶液 溶液 | 未煮沸的 溶液 溶液 |
| 无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |

分别得到如下pH-t图:

(3)A装置中覆盖食用油的目的是
(4)pH-t图中,曲线①呈缓慢下降趋势,这是因为
(5)对比分析上述四组数据,可得出的结论是
您最近一年使用:0次
名校
5 . 硫化氢广泛存在于燃气及废水中,热分解或氧化硫化氢有利于环境保护并回收硫资源。回答下列问题:
(1)写出 的电子式:
的电子式:_______ 。
(2) 与
与 溶液反应可生成两种酸式盐,该反应的离子方程式为
溶液反应可生成两种酸式盐,该反应的离子方程式为_______ 。
(3)氯气可用于除去废水中 ,写出反应的化学方程式:
,写出反应的化学方程式:_______ 。
(4)将含 尾气的空气按一定流速通入酸性
尾气的空气按一定流速通入酸性 溶液中,可实现含
溶液中,可实现含 尾气的空气脱硫。在
尾气的空气脱硫。在 溶液吸收
溶液吸收 的过程中也发生了反应
的过程中也发生了反应 ,溶液中的
,溶液中的 及被吸收的
及被吸收的 随时间t的变化如图所示。
随时间t的变化如图所示。

① 时刻前,溶液中
时刻前,溶液中 减小速率较快,
减小速率较快, 时刻后,溶液中
时刻后,溶液中 基本不变,其原因是
基本不变,其原因是_______ 。
②预测 时刻后,
时刻后, 的物质的量变化趋势,并在图中补充完整。
的物质的量变化趋势,并在图中补充完整。_______
(5)科学家设计出质子膜 燃料电池,实现了利用
燃料电池,实现了利用 废气资源回收能量并得到单质硫。质子膜
废气资源回收能量并得到单质硫。质子膜 燃料电池的结构如图所示。
燃料电池的结构如图所示。

①电极b极为_______ (填“正极”或“负极”),写出该电极的电极反应式:_______ 。
②电池工作时, 经质子膜进入
经质子膜进入_______ (填“a极”或“b极”)区。
(1)写出
 的电子式:
的电子式:(2)
 与
与 溶液反应可生成两种酸式盐,该反应的离子方程式为
溶液反应可生成两种酸式盐,该反应的离子方程式为(3)氯气可用于除去废水中
 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)将含
 尾气的空气按一定流速通入酸性
尾气的空气按一定流速通入酸性 溶液中,可实现含
溶液中,可实现含 尾气的空气脱硫。在
尾气的空气脱硫。在 溶液吸收
溶液吸收 的过程中也发生了反应
的过程中也发生了反应 ,溶液中的
,溶液中的 及被吸收的
及被吸收的 随时间t的变化如图所示。
随时间t的变化如图所示。
①
 时刻前,溶液中
时刻前,溶液中 减小速率较快,
减小速率较快, 时刻后,溶液中
时刻后,溶液中 基本不变,其原因是
基本不变,其原因是②预测
 时刻后,
时刻后, 的物质的量变化趋势,并在图中补充完整。
的物质的量变化趋势,并在图中补充完整。(5)科学家设计出质子膜
 燃料电池,实现了利用
燃料电池,实现了利用 废气资源回收能量并得到单质硫。质子膜
废气资源回收能量并得到单质硫。质子膜 燃料电池的结构如图所示。
燃料电池的结构如图所示。
①电极b极为
②电池工作时,
 经质子膜进入
经质子膜进入
您最近一年使用:0次
2022-11-16更新
|
351次组卷
|
3卷引用:辽宁省抚顺市抚顺县高级中学2022-2023学年高三上学期11月月考化学试题
解题方法
6 . 碘化钠可用于医学和摄影。实验室制备NaI的基本实验步骤为:①检查装置气密性;②关闭K,向B中滴入30%NaOH溶液,制得 ;③打开K,通入
;③打开K,通入 至饱和制得NaI,同时有黄色沉淀产生;④关闭K,向所得溶液中加入稀硫酸,水浴加热,充分逸出
至饱和制得NaI,同时有黄色沉淀产生;④关闭K,向所得溶液中加入稀硫酸,水浴加热,充分逸出 ;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸,再经过一系列操作得到NaI成品。
;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸,再经过一系列操作得到NaI成品。

回答下列问题:
(1)A装置中的仪器名称为_______ ,利用此装置还可以制取_______ (任写一种)。
(2)盛稀硫酸和30%NaOH溶液的仪器,若换成分液漏斗,其缺点是_______ 。
(3)A装置中发生反应的离子方程式为_______ 。
(4)步骤②可观察到的现象是_______ 。
(5)通入 至饱和,与
至饱和,与 反应制得NaI的离子方程式为
反应制得NaI的离子方程式为_______ 。
(6)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、_______ 等操作。
(7)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为_______ 。
 ;③打开K,通入
;③打开K,通入 至饱和制得NaI,同时有黄色沉淀产生;④关闭K,向所得溶液中加入稀硫酸,水浴加热,充分逸出
至饱和制得NaI,同时有黄色沉淀产生;④关闭K,向所得溶液中加入稀硫酸,水浴加热,充分逸出 ;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸,再经过一系列操作得到NaI成品。
;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸,再经过一系列操作得到NaI成品。
回答下列问题:
(1)A装置中的仪器名称为
(2)盛稀硫酸和30%NaOH溶液的仪器,若换成分液漏斗,其缺点是
(3)A装置中发生反应的离子方程式为
(4)步骤②可观察到的现象是
(5)通入
 至饱和,与
至饱和,与 反应制得NaI的离子方程式为
反应制得NaI的离子方程式为(6)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、
(7)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为
您最近一年使用:0次
2022-11-05更新
|
230次组卷
|
2卷引用:河南省南阳市2022-2023学年高三上学期期中质量评估化学试题
名校
解题方法
7 . 硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
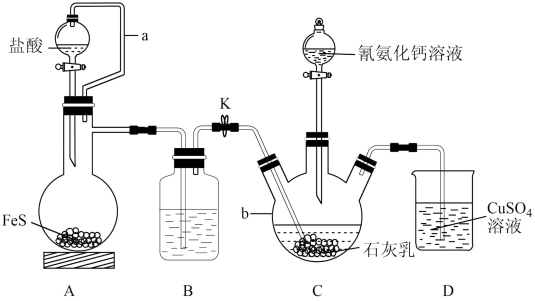
回答下列问题:
(1) 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为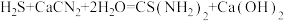 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:_______ 。
(5)装置D中可能出现的现象是_______ 。
(6)硫氰化铵( )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
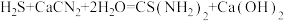 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:(5)装置D中可能出现的现象是
(6)硫氰化铵(
 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
2022-04-16更新
|
442次组卷
|
3卷引用:河北省名校联盟2021-2022学年高三下学期4月质量检测化学试题
名校
解题方法
8 . A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于野外焊接钢轨的原料,F与D同主族。
(1)D、E、F的离子半径由大到小的顺序为_______ (填离子符号)。
(2)写出能证明G比F非金属性强的一个化学方程式:_______ 。
(3)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为_______ ,该反应的化学方程式为_______ 。
(4)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为_______ 。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为_______ 。
(1)D、E、F的离子半径由大到小的顺序为
(2)写出能证明G比F非金属性强的一个化学方程式:
(3)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为
(4)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为
您最近一年使用:0次
名校
解题方法
9 . KI用于分析试剂、感光材料。制药和食品添加剂等。制备原理如下:
反应①3I2+6KOH=KIO3+5KI+3H2O
反应②3H2S+KIO3=3S↓+KI+3H2O
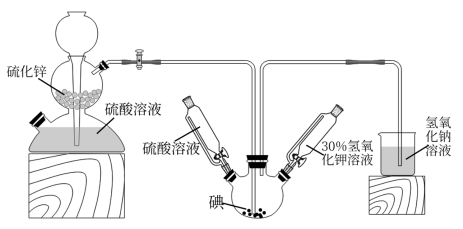
按照下列实验过程,请回答有关问题。
(1)启普发生器中发生反应的离子方程式为___________ ,用该装置还可以制备___________ (填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞。滴入30%的KOH溶液,待观察到___________ (填现象),停止滴入KOH溶液:然后___________ (填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴入硫酸溶液。并对KI混合液水浴加热,其目的是___________ 。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和___________ ,其中加入碳酸钡的作用是___________ 。合并滤液和洗液,蒸发至析出结晶。滤出经干燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为___________ g。
反应①3I2+6KOH=KIO3+5KI+3H2O
反应②3H2S+KIO3=3S↓+KI+3H2O

按照下列实验过程,请回答有关问题。
(1)启普发生器中发生反应的离子方程式为
(2)关闭启普发生器活塞,打开滴液漏斗的活塞。滴入30%的KOH溶液,待观察到
(3)滴入硫酸溶液。并对KI混合液水浴加热,其目的是
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和
(5)如果得到3.2g硫单质,则理论上制得的KI为
您最近一年使用:0次
名校
解题方法
10 . ag H2S气体通入100mL0.15mol/L的Fe2(SO4)3溶液中完全反应后,再加过量铁粉,则
A.反应后溶液含有0.045mol的 | B.可产生 |
| C.a的值一定为0.51 | D.加入铁粉的质量可能为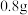 |
您最近一年使用:0次
2021-09-29更新
|
649次组卷
|
2卷引用:江西省丰城市第九中学2021-2022学年高三上学期复读班第二次月考化学试题



