解题方法
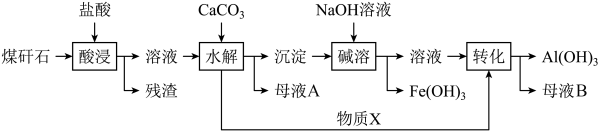
1 . 我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
已知:
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是_________ 。物质X的化学式为_______ 。
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)____________ 、__________ 。
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________ 。
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是____________ 。
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH)。该电池反应的化学方程式是____________________ 。
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品。则预处理后的100t煤矸石中铝元素的回收率为_________________ 。

已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH)。该电池反应的化学方程式是
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品。则预处理后的100t煤矸石中铝元素的回收率为
您最近一年使用:0次
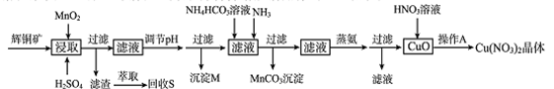
2 . 辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式__________ 。
(2)调节pH的目的是___________ ,pH的调节范围为___________ 。
(3)生成MnCO3沉淀的离子方程式为___________ 。
(4)操作A为___________ 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___________ 。
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备__________ mol无水Cu(NO3)2。(计算结果精确到小数点后1位)

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式
(2)调节pH的目的是
(3)生成MnCO3沉淀的离子方程式为
(4)操作A为
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备
您最近一年使用:0次
2016-03-18更新
|
590次组卷
|
3卷引用:2016届四川省眉山广安等四市高三上学期第一次诊断性联考理综化学试卷



