1 . 铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如图:

请回答下列问题:
(1)沉淀B的化学式为____ ,溶液C中阴离子主要是____ 。
(2)操作I是____ (填操作名称)。
(3)写出①过程中发生反应的离子方程式_____ 。
(4)Al(OH)3沉淀必须进行洗涤才能通过操作IV获得纯净Al2O3,操作IV是____ (填操作名称)。
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有____ (填化学式)。

请回答下列问题:
(1)沉淀B的化学式为
(2)操作I是
(3)写出①过程中发生反应的离子方程式
(4)Al(OH)3沉淀必须进行洗涤才能通过操作IV获得纯净Al2O3,操作IV是
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有
您最近一年使用:0次
名校
2 . 硫酸铁是一种重要的化工原料,用铁矿石(主要成分为 ,还含有少量的FeO、
,还含有少量的FeO、 、
、 、有机杂质)制备硫酸铁的流程如下:
、有机杂质)制备硫酸铁的流程如下:
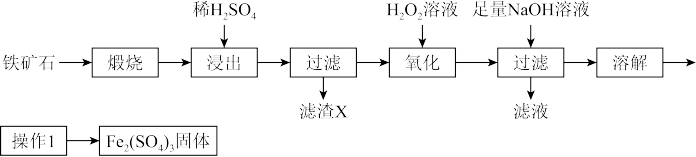
已知: 既不与酸反应,也不与水反应。
既不与酸反应,也不与水反应。
(1)请写出“浸出”过程中 与
与 反应的离子方程式:
反应的离子方程式:_______ ;浸出时,一边加入稀硫酸,一边搅拌的目的是_______ 。
(2)“滤渣X”的成分为_______ 。
(3)“氧化”的目的是_______ ;过程中发生的离子方程式为_______ 。
(4)证明滤液中 已沉淀完全的实验操作和结论为
已沉淀完全的实验操作和结论为_______ 。
(5)用相似的工艺还可以制取另一种含铁硫酸盐晶体——绿矾。绿矾产品可以制取摩尔盐,摩尔盐是一种重要的化工原料,广泛应用于医药冶金等领域,其化学组成可表示为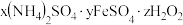 。为确定摩尔盐的组成,进行如下实验:
。为确定摩尔盐的组成,进行如下实验:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取10.00mL溶液A,加入足量 溶液,充分反应后过滤、洗涤、干燥,得白色固体4.660g。
溶液,充分反应后过滤、洗涤、干燥,得白色固体4.660g。
步骤三:另取10.00mL溶液A,加入0.0500
 酸性溶液,发生反应:
酸性溶液,发生反应: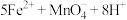
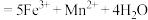 ,当两者恰好完全反应时,消耗
,当两者恰好完全反应时,消耗 溶液的体积为40.00mL。
溶液的体积为40.00mL。
通过计算确定摩尔盐中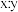 的值:
的值:_______ (写出计算过程)。
 ,还含有少量的FeO、
,还含有少量的FeO、 、
、 、有机杂质)制备硫酸铁的流程如下:
、有机杂质)制备硫酸铁的流程如下:
已知:
 既不与酸反应,也不与水反应。
既不与酸反应,也不与水反应。(1)请写出“浸出”过程中
 与
与 反应的离子方程式:
反应的离子方程式:(2)“滤渣X”的成分为
(3)“氧化”的目的是
(4)证明滤液中
 已沉淀完全的实验操作和结论为
已沉淀完全的实验操作和结论为(5)用相似的工艺还可以制取另一种含铁硫酸盐晶体——绿矾。绿矾产品可以制取摩尔盐,摩尔盐是一种重要的化工原料,广泛应用于医药冶金等领域,其化学组成可表示为
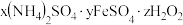 。为确定摩尔盐的组成,进行如下实验:
。为确定摩尔盐的组成,进行如下实验:步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取10.00mL溶液A,加入足量
 溶液,充分反应后过滤、洗涤、干燥,得白色固体4.660g。
溶液,充分反应后过滤、洗涤、干燥,得白色固体4.660g。步骤三:另取10.00mL溶液A,加入0.0500

 酸性溶液,发生反应:
酸性溶液,发生反应: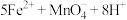
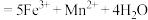 ,当两者恰好完全反应时,消耗
,当两者恰好完全反应时,消耗 溶液的体积为40.00mL。
溶液的体积为40.00mL。通过计算确定摩尔盐中
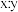 的值:
的值:
您最近一年使用:0次
2022-02-23更新
|
372次组卷
|
3卷引用:吉林省松原市重点高中2021-2022学年高一3月联考化学试题
名校
3 . 碱式硫酸铁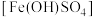 是一种用于污水处理的新型高效絮凝剂。工上业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
是一种用于污水处理的新型高效絮凝剂。工上业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
完成下列填空:
(1)反应Ⅰ后的溶液中存在的阳离子有_______ 。
(2)加入少量 的目的是将溶液的pH调节在
的目的是将溶液的pH调节在_______ 范围内,从而使溶液中的_______ 。该工艺中“搅拌”的作用是_______ 。
(3)反应Ⅱ加入 的目的是氧化
的目的是氧化 ,反应的离子方程式为
,反应的离子方程式为_______ 。在实际生产中,反应Ⅱ常同时通入 以减少
以减少 的用量,若参与反应的
的用量,若参与反应的 有
有 (标准状况),则相当于节约了
(标准状况),则相当于节约了
_______ g。
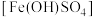 是一种用于污水处理的新型高效絮凝剂。工上业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
是一种用于污水处理的新型高效絮凝剂。工上业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
| 沉淀物 |  |  |  |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ后的溶液中存在的阳离子有
(2)加入少量
 的目的是将溶液的pH调节在
的目的是将溶液的pH调节在(3)反应Ⅱ加入
 的目的是氧化
的目的是氧化 ,反应的离子方程式为
,反应的离子方程式为 以减少
以减少 的用量,若参与反应的
的用量,若参与反应的 有
有 (标准状况),则相当于节约了
(标准状况),则相当于节约了
您最近一年使用:0次
2021-09-19更新
|
162次组卷
|
2卷引用:吉林省长春外国语学校2021-2022学年高二上学期第二次月考化学试题
解题方法
4 . 某工厂从含硫酸钡、氧化铜、氧化亚铁、氧化铝和少量氧化银的废渣中回收金属的工艺流程如图所示:

(1)滤渣①的化学式为___________ ,是___________ (填“强”“弱”或“非”)电解质。
(2)用滤渣②作粗铜电解精炼铜时,粗铜作___________ (填“阳”或“阴”)极。
(3)加入过量铁粉,被还原的金属阳离子有___________ 。过氧化钠的电子式为___________ 。
(4)滤液④的溶质是___________ 。B电解方程式为___________ 。
(5)写出滤渣③生成A的化学方程式:___________ 。

(1)滤渣①的化学式为
(2)用滤渣②作粗铜电解精炼铜时,粗铜作
(3)加入过量铁粉,被还原的金属阳离子有
(4)滤液④的溶质是
(5)写出滤渣③生成A的化学方程式:
您最近一年使用:0次
解题方法
5 . 工业上从铝土矿(主要成分是Al2O3还含有SiO2、Fe2O3等杂质)中提取铝可使用如下工艺流程:

已知:SiO2不溶于水且不与盐酸反应。请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是______ (填操作名称)。
(2)步骤(Ⅱ)中加入的烧碱溶液应该是______ (填“少量”或“过量”)。溶液D中含铝元素的溶质的是______ (填化学式)。
(3)①物质M在生产生活中有重要用途,写出沉淀F转化为物质M的化学方程式______ 。
②溶液D中通入CO2生成沉淀F的离子方程式为______ 。

已知:SiO2不溶于水且不与盐酸反应。请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是
(2)步骤(Ⅱ)中加入的烧碱溶液应该是
(3)①物质M在生产生活中有重要用途,写出沉淀F转化为物质M的化学方程式
②溶液D中通入CO2生成沉淀F的离子方程式为
您最近一年使用:0次
解题方法
6 . 用铝灰 冶铝废弃物,主要成分是
冶铝废弃物,主要成分是 含少量杂质
含少量杂质 、FeO、
、FeO、 作原料可制取硫酸铝铵晶体,其制备流程如图。下列说法错误的是
作原料可制取硫酸铝铵晶体,其制备流程如图。下列说法错误的是

 冶铝废弃物,主要成分是
冶铝废弃物,主要成分是 含少量杂质
含少量杂质 、FeO、
、FeO、 作原料可制取硫酸铝铵晶体,其制备流程如图。下列说法错误的是
作原料可制取硫酸铝铵晶体,其制备流程如图。下列说法错误的是
| A.为提高铝灰的浸取率可以加入热的稀硫酸 |
B.滤渣a的成分为 |
C.氧化过程中发生反应的离子方程式为 |
| D.操作X包括蒸发浓缩、冷却结晶、过滤、洗涤和干燥等操作 |
您最近一年使用:0次
名校
解题方法
7 . 某混合物浆液含Al(OH)3、MnO2和少量Na2Cr2O4。考虑到胶体的吸附作用使Na2Cr2O4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图1),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
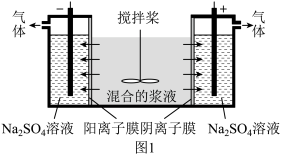
固体混合物的分离和利用的流程图如图2所示(流程图中的部分分离操作和反应条件未标明):
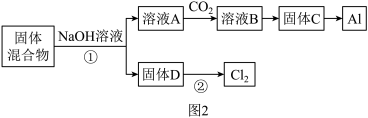
(1)反应①所加试剂NaOH的电子式为___ ,B→C的反应条件为___ ,C→Al的制备方法称为___ 。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有___ (填序号)。
a.温度 b.Cl-的浓度 c.溶液的酸度

固体混合物的分离和利用的流程图如图2所示(流程图中的部分分离操作和反应条件未标明):

(1)反应①所加试剂NaOH的电子式为
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有
a.温度 b.Cl-的浓度 c.溶液的酸度
您最近一年使用:0次
2020-04-09更新
|
255次组卷
|
5卷引用:吉林省长春市东北师大附中2020届高中毕业班四月份教学质量监测卷理科综合化学部分
名校
8 . 从铝热法冶炼金属铬的废渣(含Al2O3和Cr2O3等)中回收铬和铝的工艺流程如下:

下列说法错误的是

下列说法错误的是
| A.合理处理废渣有利于保护环境和资源再利用 |
| B.滤渣2主要成分为Al(OH)3并可能含少量NaHCO3 |
| C.滤液3中含Na2SO4、(NH4)2SO4及Na2CO3等 |
| D.流程中发生氧化还原反应的步骤有①③④ |
您最近一年使用:0次
2020-02-19更新
|
234次组卷
|
3卷引用:吉林省长春六中、八中、十一中等省重点中学2020届高三12月联考化学试题
吉林省长春六中、八中、十一中等省重点中学2020届高三12月联考化学试题天津市静海区第一中学2021届高三上学期期末考试化学试题(已下线)课时19 金属元素为载体的化工流程选择题-2022年高考化学一轮复习小题多维练(全国通用)
解题方法
9 . 硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

已知:硼酸为粉末状晶体,易溶于水,加热到一定温度可分解为无水物。
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式___ 。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有(写两条):___ 。
(2)“浸渣”中还剩余的物质是:___ (写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是___ 。然后再调节溶液的pH约为5,目的是___ 。
(4)“粗硼酸”中的主要杂质是___ (填名称)。
(5)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___ 。

已知:硼酸为粉末状晶体,易溶于水,加热到一定温度可分解为无水物。
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式
(2)“浸渣”中还剩余的物质是:
(3)“净化除杂”需先加H2O2溶液,作用是
(4)“粗硼酸”中的主要杂质是
(5)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程
您最近一年使用:0次
10 . 已知铝土矿主要成分为Al2O3,还含有少量的Fe2O3、SiO2等杂质。如图是工业上冶炼铝的工艺流程图:

(1)操作Ⅰ和Ⅱ是用于分离溶液和沉淀,称为__ 。需要用到哪些玻璃仪器__ 。
(2)操作Ⅰ分离出的沉淀除了含有泥沙外,一定还含有__ ,滤液X中,含铝元素的溶质的化学式为__ 。写出步骤②中与过量CO2反应的离子方程式___ 。
(3)操作Ⅱ得到的沉淀除了氢氧化铝还有___ ,它属于___ (填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往氯化铝溶液中加入___ (填“氨水”或“NaOH溶液”)制取氢氧化铝,写出对应的离子方程式___ 。

(1)操作Ⅰ和Ⅱ是用于分离溶液和沉淀,称为
(2)操作Ⅰ分离出的沉淀除了含有泥沙外,一定还含有
(3)操作Ⅱ得到的沉淀除了氢氧化铝还有
(4)实验室里常往氯化铝溶液中加入
您最近一年使用:0次



