名校
解题方法
1 . 某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可能大量共存的离子组是
A.K+、NH 、HCO 、HCO 、NO 、NO | B.Na+、SO 、Cl-、ClO- 、Cl-、ClO- |
C.Na+、Fe2+、SO 、NO 、NO | D.K+、Na+、SO 、S2- 、S2- |
您最近一年使用:0次
2 . 只用一种试剂即可鉴别Na2SO4、NaCl、(NH4)2SO4、AlCl3四种溶液,这种试剂是
| A.氨水 | B.Ba(OH)2溶液 | C.NaOH溶液 | D.AgNO3溶液 |
您最近一年使用:0次
3 . “神舟十三号”飞船所使用的砷化镓太阳能电池是我国自主研发、自主生产的产品,拥有全部知识产权。砷(As)和镓(Ga)都位于第四周期,分别位于第VA族和第IIIA族。下列说法不正确的是
A.原子半径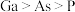 |
B.热稳定性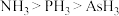 |
C.酸性: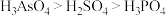 |
D.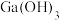 的化学性质可能与 的化学性质可能与 相似 相似 |
您最近一年使用:0次
2022-11-18更新
|
1697次组卷
|
5卷引用:北京市第十中学2022-2023学年高三上学期等级考适应性练习(三模)化学试题
北京市第十中学2022-2023学年高三上学期等级考适应性练习(三模)化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第1章02基础练北京市第一六六中学2023-2024学年高三上学期期中考试化学试题北京市第五中学2023-2024学年高三上学期12月月考化学试题(已下线)第一章 原子结构与性质(A卷)
解题方法
4 . 探究氢氧化铝的两性,最适宜的试剂是
| A.AlCl3、氨水、稀盐酸 | B.Al2O3、氨水、稀盐酸 |
| C.Al、NaOH溶液、稀盐酸 | D.Al2(SO4)3溶液、NaOH溶液、稀盐酸 |
您最近一年使用:0次
名校
5 . 铝、铁是生产、生活中常见的金属,其合金与盐在各领域都有着广泛的应用。
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
(2)铝元素在周期表中的位置是_______ 。写出 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式_______ 。铁粉与水蒸气在高温条件下反应,生成的固态产物是_______ 。
(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。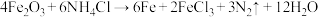 ;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为
;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为_______ 个,有同学认为,该反应产物中不应该有Fe生成,他的理由是(用化学方程式表示原因)_______ 。
(4)现有仪器和药品:试管和胶头滴管,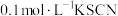 溶液、
溶液、 酸性
酸性 溶液、
溶液、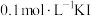 溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
| A.不易生锈 | B.导电性好 | C.密度小 | D.硬度大 |
 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。
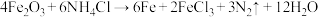 ;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为
;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为(4)现有仪器和药品:试管和胶头滴管,
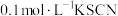 溶液、
溶液、 酸性
酸性 溶液、
溶液、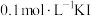 溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴 溶液。 溶液。 | |
| 第二步 |  。 。 |
您最近一年使用:0次
2022-06-28更新
|
230次组卷
|
2卷引用:上海市宜川中学2021-2022学年高一下学期期末考试化学试题
6 . 化学与生产、生活等密切相关,下列有关说法中错误的是
| A.碳酸镁和氢氧化铝等均可作抗酸胃药 | B.漂白液、漂白粉的有效成分均是次氯酸钙 |
| C.CO、甲醛等都是室内空气污染物 | D.中和法和沉淀法是常用的工业污水处理方法 |
您最近一年使用:0次
2022-06-05更新
|
209次组卷
|
4卷引用:专题02 突破化学与生产生活(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
(已下线)专题02 突破化学与生产生活(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)湖北省新高考部分校2021-2022学年高三下学期5月质量检测化学试题(已下线)2022年湖南卷高考真题变式题(1-10)湖北省九师联盟2022届高三5月质量检测化学试题
7 . 下列有关物质的性质与用途具有对应关系的是
A. 硬度大,可用作光导纤维 硬度大,可用作光导纤维 |
| B.Li质量轻、比能量大,可用作电池正极材料 |
C. 有漂白性,可用作葡萄酒的添加剂 有漂白性,可用作葡萄酒的添加剂 |
D. 有弱碱性,可用于中和胃酸 有弱碱性,可用于中和胃酸 |
您最近一年使用:0次
2022-05-31更新
|
806次组卷
|
9卷引用:湖南省长沙市长郡中学2022届高三模拟考试(二)化学试题
湖南省长沙市长郡中学2022届高三模拟考试(二)化学试题(已下线)专题06 元素化合物及其性质-备战2023年高考化学母题题源解密(全国通用)上海市复兴高级中学2022-2023学年高三上学期10月月考化学试题(已下线)选择题1-5湖北省武汉市新洲区部分学校2023-2024学年高三上学期期中考试化学试题(已下线)2022年江苏卷高考真题变式题1-13江苏省南京镇江八校2023届高三上学期第一次联考化学试题江苏省建湖高级中学2023-2024学年高三上学期暑期学情检测(一)化学试题江苏省张家港市沙洲中学2023-2024学年高二下学期3月阶段性测试化学试题
名校
8 . 下列有关物质的性质与用途具有对应关系的是
| A.晶体Si熔点高,可用作计算机芯片 |
| B.NH4HCO3受热易分解,可用作氮肥 |
| C.SO2具有还原性,可用于漂白纸浆 |
| D.Al(OH)3能与酸反应,可用作抗胃酸药 |
您最近一年使用:0次
2022-05-28更新
|
441次组卷
|
3卷引用:第四章 非金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)
(已下线)第四章 非金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)江苏省南通市2022届高三第四次模拟考试化学试题江苏省徐州市第七中学2022-2023学年高三上学期10月学情调研化学试题
名校
9 . 如图是部分短周期元素的主要化合价与原子序数的关系,下列说法正确的是


A.最高正化合价: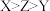 |
B.简单气态氢化物的热稳定性: |
C.最高价氧化物对应水化物的碱性: |
| D.R和Z二者最高价氧化物对应的水化物在水中不能发生反应 |
您最近一年使用:0次
2022-04-30更新
|
221次组卷
|
4卷引用:陕西省汉中市2021-2022学年高一下学期期中考试化学试题
陕西省汉中市2021-2022学年高一下学期期中考试化学试题陕西省咸阳市武功县2021-2022学年高一下学期期中质量调研化学试题(已下线)第10练 元素周期律-2023年高考化学一轮复习小题多维练(全国通用)浙江省舟山市普陀中学2021-2022学年高一下学期5月月考化学试题
解题方法
10 . 比较钠、镁、铝三种元素原子失电子能力的相对强弱
【实验探究1】钠、镁、铝与水的反应
向滴有酚酞的水中分别加入绿豆大小的钠,观察现象;加入用砂纸打磨后的镁条,观察现象,用酒精灯加热后,再观察实验现象;加入用砂纸打磨后的铝条,观察现象,用酒精灯加热后,再观察实验现象。
【实验探究2】镁、铝与酸的反应
向稀盐酸中分别加入加入经砂纸打磨后的镁条和铝条,观察现象和反应的剧烈程度。
【实验探究3】比较NaOH、Mg(OH)2、Al(OH)3三者的碱性强弱
氢氧化铝的化学性质-_______
①与强酸反应(例如,盐酸)
化学方程式:_______
离子方程式:_______
②与强碱反应(例如,氢氧化钠)
化学方程式:_______
离子方程式:_______
【实验探究1】钠、镁、铝与水的反应
向滴有酚酞的水中分别加入绿豆大小的钠,观察现象;加入用砂纸打磨后的镁条,观察现象,用酒精灯加热后,再观察实验现象;加入用砂纸打磨后的铝条,观察现象,用酒精灯加热后,再观察实验现象。
| 单质 | 钠 | 镁 | 铝 |
| 与水反应现象 | 与冷水剧烈反应,产生无色气体,溶液变红 | 与冷水无明显现象,加热后有气泡,溶液变粉红 | 与冷水不反应,加热后与水也极难发生反应 |
| 化学反应方程式 | 2Na+2H2O=2NaOH+H2↑ | Mg+2H2O Mg(OH)2+H2↑ Mg(OH)2+H2↑ | - |
| 结论 | 失电子能力(金属性):Na>Mg>Al | ||
向稀盐酸中分别加入加入经砂纸打磨后的镁条和铝条,观察现象和反应的剧烈程度。
| 单质 | 钠 | 镁 | 铝 |
| 与稀盐酸反应现象 | 与冷水剧烈反应,产生无色气体 | 反应较快,产生无色气体 | 反应较慢,产生无色气体 |
| 化学反应方程式 | 2Na+2HCl=2NaCl+H2↑ | Mg+2HCl=MgCl2+H2↑ | 2Al+6HCl=2AlCl3+3H2↑ |
| 结论 | 失电子能力(金属性):Na>Mg>Al | ||
| 氯化镁 | 氯化铝 | |
| 逐滴滴加氢氧化钠溶液至过量,现象 | 产生白色沉淀,沉淀不消失 | 产生白色沉淀,后白色沉淀溶解 |
| 化学反应方程式 | MgCl2+2NaOH=Mg(OH)2↓+2NaCl | AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=Na[Al(OH)4] |
| 结论 | 碱性:NaOH>Mg(OH)2>Al(OH)3 | |
①与强酸反应(例如,盐酸)
化学方程式:
离子方程式:
②与强碱反应(例如,氢氧化钠)
化学方程式:
离子方程式:
您最近一年使用:0次



