1 . 实验室制备硝酸铝[Al(NO3)3·9H2O]可使用下列方法:

反映上述有关的离子方程式错误的是

反映上述有关的离子方程式错误的是
| A.2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ |
B. +[Al(OH)4]-=CO2↑+Al(OH)3↓+H2O +[Al(OH)4]-=CO2↑+Al(OH)3↓+H2O |
| C.NH4++[Al(OH)4]-=NH3·H2O+Al(OH)3↓ |
| D.3H++Al(OH)3=Al3++3H2O |
您最近一年使用:0次
2 . 用0.11mol·L-1的NaOH溶液滴定0.0125 mol·L-1的Al2(SO4)3溶液,滴定过程中的pH变化如下图所示。已知M点开始出现轻微沉淀,用激光笔照射时有明显的丁达尔现象;N点不再产生明显的沉淀;O点沉淀开始溶解。已知浓氨水的pH最大可达到11.7左右。下列相关说法错误的是


A.滴定前溶液呈酸性的主要原因是Al3++3H2O Al(OH)3+3H+ Al(OH)3+3H+ |
| B.M点之前发生反应的离子方程式为H++OH-=H2O |
| C.OP段发生反应的离子方程式为Al3++4OH-=[Al(OH)4]- |
| D.根据该实验数据可知Al(OH)3在浓氨水中可部分溶解 |
您最近一年使用:0次
3 . 纳米 和纳米
和纳米 均为多功能性的新型无机材料,在陶瓷、电子、光学等领域有着重要的应用价值。某科学小组尝试利用废旧镀锌铁皮制备纳米
均为多功能性的新型无机材料,在陶瓷、电子、光学等领域有着重要的应用价值。某科学小组尝试利用废旧镀锌铁皮制备纳米 和纳米
和纳米 的部分流程如下:
的部分流程如下:
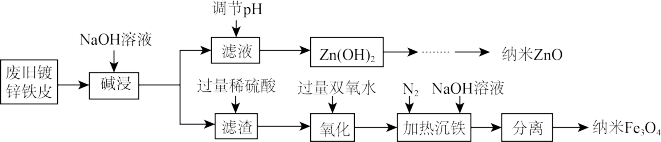
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
请回答下列问题:
(1)铁皮镀锌在金属的电化学防护中属于_______ 法。
(2)调节滤液pH时,pH不能太低的原因为_______ (用离子方程式表示)。
(3)向“碱浸”后得到的滤渣中加入过量稀硫酸时,硫酸不能过量太多的原因为_______ 。
(4)写出“氧化”阶段的离子方程式:_______ ;“加热沉铁”阶段需要持续通入 ,其原因为
,其原因为_______ 。
(5)若“分离”阶段在实验室中进行,可选用的实验装置为_______ (填字母)。
 和纳米
和纳米 均为多功能性的新型无机材料,在陶瓷、电子、光学等领域有着重要的应用价值。某科学小组尝试利用废旧镀锌铁皮制备纳米
均为多功能性的新型无机材料,在陶瓷、电子、光学等领域有着重要的应用价值。某科学小组尝试利用废旧镀锌铁皮制备纳米 和纳米
和纳米 的部分流程如下:
的部分流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
请回答下列问题:
(1)铁皮镀锌在金属的电化学防护中属于
(2)调节滤液pH时,pH不能太低的原因为
(3)向“碱浸”后得到的滤渣中加入过量稀硫酸时,硫酸不能过量太多的原因为
(4)写出“氧化”阶段的离子方程式:
 ,其原因为
,其原因为(5)若“分离”阶段在实验室中进行,可选用的实验装置为

您最近一年使用:0次
2022-09-07更新
|
456次组卷
|
2卷引用:河南省焦作市第一中学2022-2023学年高三上学期定位考试化学试题
4 . 某兴趣小组以铝土矿(主要成分为 ,还含有少量
,还含有少量 和
和 )为主要原料制备絮凝剂聚合氯化铝
)为主要原料制备絮凝剂聚合氯化铝 和金属铝的流程如图所示。
和金属铝的流程如图所示。
 ,还含有少量
,还含有少量 和
和 )为主要原料制备絮凝剂聚合氯化铝
)为主要原料制备絮凝剂聚合氯化铝 和金属铝的流程如图所示。
和金属铝的流程如图所示。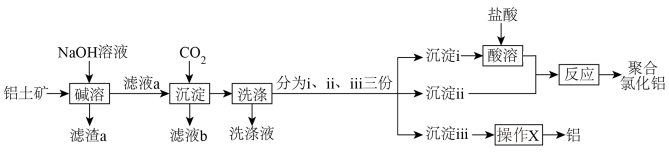
| A.“碱溶”时,所用NaOH溶液可更换为氨水 |
B.若滤液a浓度较大,“沉淀”时通入过量 有利于减少生成沉淀中的杂质 有利于减少生成沉淀中的杂质 |
| C.通过控制沉淀ⅰ、ⅱi的比例可改变聚合氯化铝的组成 |
| D.“操作X”可以是盐酸溶解、结晶、脱水、电解 |
您最近一年使用:0次
2023-12-16更新
|
492次组卷
|
3卷引用:河南省青铜鸣大联考2023-2024学年高三上学期12月月考化学试题
解题方法
5 . 明矾[KAl(SO4)2·12H2O]是一种常用的净水剂。以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾晶体的实验流程如下:

(1)“碱溶”步骤中发生反应的化学方程式为_______ 。
(2)“沉铝”步骤在煮沸条件下进行,生成Al(OH)3、NH3和NaHCO3。检验“沉铝所得滤液中阳离子的操作为_______ 。
(3)由浓硫酸配制250 mL“酸溶”所需的9 mol/H2SO4溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、_______ 、_______ 。
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是_______ ,圆底烧瓶中发生反应的离子方程式为_______ 。

(5)已知明矾、硫酸铝、硫酸钾的溶解度随温度的变化如图所示:

请将制备明矾晶体的实验方案补充完整:将“酸溶”所得溶液转移至蒸发皿中,_______ ,过滤,冷水洗涤,干燥,得到明矾晶体(实验中需用到的试剂:K2SO4固体)。

(1)“碱溶”步骤中发生反应的化学方程式为
(2)“沉铝”步骤在煮沸条件下进行,生成Al(OH)3、NH3和NaHCO3。检验“沉铝所得滤液中阳离子的操作为
(3)由浓硫酸配制250 mL“酸溶”所需的9 mol/H2SO4溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是

(5)已知明矾、硫酸铝、硫酸钾的溶解度随温度的变化如图所示:

请将制备明矾晶体的实验方案补充完整:将“酸溶”所得溶液转移至蒸发皿中,
您最近一年使用:0次
6 . 氢氧化铝可作胃酸的中和剂。(_____)
您最近一年使用:0次
7 . 粉煤灰的综合利用既有利于节约资源,又有利于保护环境。以粉煤灰(主要含 、
、 、
、 等)为原料制取
等)为原料制取 的一种工艺流程如下:
的一种工艺流程如下:

(1)酸浸时 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)沉铝、铁后,检验溶液中是否还含有 的方法是
的方法是_______ 。
(3)蒸氨时反应的离子方程式为_______ 。
(4)过滤所得 和
和 经过分离后可以制取
经过分离后可以制取 溶液。
溶液。
①过滤后沉淀需要洗涤,检验沉淀是否洗涤干净的方法是_______ 。
②设计由 和
和 制取
制取 溶液的实验方案:
溶液的实验方案:_______ 。(实验中可以使用的试剂是盐酸和NaOH溶液)
 、
、 、
、 等)为原料制取
等)为原料制取 的一种工艺流程如下:
的一种工艺流程如下:
(1)酸浸时
 发生反应的离子方程式为
发生反应的离子方程式为(2)沉铝、铁后,检验溶液中是否还含有
 的方法是
的方法是(3)蒸氨时反应的离子方程式为
(4)过滤所得
 和
和 经过分离后可以制取
经过分离后可以制取 溶液。
溶液。①过滤后沉淀需要洗涤,检验沉淀是否洗涤干净的方法是
②设计由
 和
和 制取
制取 溶液的实验方案:
溶液的实验方案:
您最近一年使用:0次
名校
解题方法
8 . T、Q、R、W四种元素在元素周期表中所处位置如图,已知W元素能与氧元素形成化合物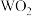 ,
,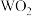 中氧的质量分数为50%,且W原子中质子数等于中子数。下列说法错误的是
中氧的质量分数为50%,且W原子中质子数等于中子数。下列说法错误的是
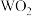 ,
,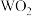 中氧的质量分数为50%,且W原子中质子数等于中子数。下列说法错误的是
中氧的质量分数为50%,且W原子中质子数等于中子数。下列说法错误的是| Q | R | ||
| T | W |
| A.最高价氧化物对应水化物的酸性:Q>W | B.T的最高价氧化物能与某些强酸反应 |
| C.R的最外层电子数为5 | D.Q的氧化物不止一种 |
您最近一年使用:0次
2023-02-11更新
|
297次组卷
|
2卷引用:河北省承德市2022-2023学年高一上学期期末考试化学试题
名校
9 . 铝、铁是生产、生活中常见的金属,其合金与盐在各领域都有着广泛的应用。
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
(2)铝元素在周期表中的位置是_______ 。写出 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式_______ 。铁粉与水蒸气在高温条件下反应,生成的固态产物是_______ 。
(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。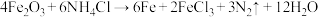 ;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为
;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为_______ 个,有同学认为,该反应产物中不应该有Fe生成,他的理由是(用化学方程式表示原因)_______ 。
(4)现有仪器和药品:试管和胶头滴管,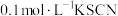 溶液、
溶液、 酸性
酸性 溶液、
溶液、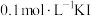 溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
| A.不易生锈 | B.导电性好 | C.密度小 | D.硬度大 |
 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。
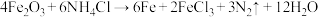 ;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为
;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为(4)现有仪器和药品:试管和胶头滴管,
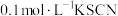 溶液、
溶液、 酸性
酸性 溶液、
溶液、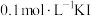 溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴 溶液。 溶液。 | |
| 第二步 |  。 。 |
您最近一年使用:0次
2022-06-28更新
|
230次组卷
|
2卷引用:上海市宜川中学2021-2022学年高一下学期期末考试化学试题
10 . 表述Ⅰ与表述Ⅱ中,两者之间因果关系错误 的是
| 选项 | 表述Ⅰ | 表述Ⅱ |
| A | 金属钠保存在煤油中,以隔绝空气 | 常温下,金属钠在空气中会发生反应 |
| B | 用 溶液腐蚀印刷电路板 溶液腐蚀印刷电路板 |  溶液能与 溶液能与 反应 反应 |
| C | 将干燥的氯气通入盛有红色鲜花的集气瓶中,鲜花褪色 | 干燥的氯气具有漂白性 |
| D | 氢氧化铝可用于治疗胃酸过多 | 氢氧化铝可与盐酸反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-23更新
|
233次组卷
|
2卷引用:安徽省安庆市2021-2022学年高一上学期期末考试化学试题



