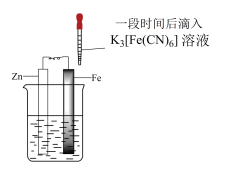
1 . 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确 的是
| ① | ② | ③ |
|
|
|
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
| A.对比②③,可以判定Zn保护了Fe |
| B.对比①②,K3[Fe(CN)6]可能将Fe氧化 |
| C.验证Zn保护Fe时不能用①的方法 |
| D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼 |
您最近一年使用:0次
2018-06-09更新
|
11570次组卷
|
78卷引用:北京市通州区2019-2020学年高二下学期期末考试化学试题
北京市通州区2019-2020学年高二下学期期末考试化学试题北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题2018年全国普通高等学校招生统一考试化学(北京卷)【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题1四川省攀枝花市2018-2019学年高二下学期期末调研检测化学试题江西省宜春市宜丰县宜丰中学2019-2020学年高二下学期开学考试化学试题河南省驻马店市2018-2019学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第四章素养检测人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第三节 金属的腐蚀与防护1人教版(2019)高二化学选择性必修1第四章 化学反应与电能 过高考 3年真题强化闯关(已下线)第四章 化学反应与电能(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)河南省郑州市郑州中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研化学试题江苏省泰州中学2020-2021学年高二上学期期中考试化学试题(已下线)练习16 金属的电化学腐蚀-2020-2021学年【补习教材·寒假作业】高二化学(人教版)辽宁省丹东市2020-2021学年高二上学期期末考试化学试题甘肃省陇南市徽县第二中学2020-2021学年高二上学期期末考试化学试题四川省三台中学实验学校2020-2021学年高二下学期开学考试理综化学试题江苏省泰州中学2021-2022学年高二上学期第一次月度检测化学试题河南省南阳市第一中学校2021-2022学年高二上学期第二次月考化学试题福建省厦门市厦门双十中学2021-2022学年上学期期中考试化学试题山东省泰安第二中学2021-2022学年高二上学期期中考试化学试题(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)河南省重点高中2021-2022学年高二上学期阶段性调研联考二化学试题河南省中原名校联盟2021-2022学年高二上学期第三次适应性联考化学试题广东省东莞市七校2021-2022学年高二下学期期中联考化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题山东省枣庄市第三中学(实验班)2022-2023学年高二11月线上测试化学试题河南省洛阳市2022-2023学年高二上学期期末考试化学试题辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题天津市第一中学2022-2023学年高二上学期期末考试化学试题作业(二十六) 金属的腐蚀与防护云南省普洱市第一中学2022-2023学年高二下学期期末考试化学试题第四章 化学反应与电能 第三节 金属的腐蚀与防护山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题福建省泉州市泉港区第一中学2023-2024学年高二上学期12月月考化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题山东省百师联盟2023-2024学年高二上学期12月大联考化学试题 陕西省安康市2023-2024学年高二上学期12月联考化学试题(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础安徽省阜阳市第三中学竞培中心2017-2018学年高一年级第二学期第三次调研考试化学试题(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)浙江省东阳中学2018-2019学年高一下学期期中考试化学试题四川省树德中学2020届高三11月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高三上学期11月月考化学试题四川省成都市龙泉第二中学2019-2020学年高三上学期1月月考理科综合化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)专题6.3 电解池 金属的腐蚀与防护(练)——2020年高考化学一轮复习讲练测江西省宜春市2020届高三5月模拟理科综合-化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(讲)——2020年高考化学一轮复习讲练测河南省漯河市临颍县南街高级中学2020届高三阶段性测试化学试题(已下线)第21讲 电解池 金属的电化学腐蚀与防护 (精讲)——2021年高考化学一轮复习讲练测(已下线)小题必刷26 电解池原理及其应用——2021年高考化学一轮复习小题必刷(通用版本)福建省平和县第一中学2021届高三年上学期第二次月考化学试题陕西省咸阳市2021届高考五月检测三模理综化学试题(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第17讲 电解池 金属的腐蚀与防护(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)山东省实验中学2022届高三第一次诊断考试化学试题(已下线)2020年江苏卷化学高考真题变式题11-15山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题山东省泰安市泰安一中2021-2022学年高一下学期6月学情诊断化学试题(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)重庆市西南大学附属中学校2021-2022学年高一广延班下学期期末考试化学试题(已下线)第17讲 电解池 金属的腐蚀与防护 (练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)题型107 电化学原理在金属防腐蚀中的应用(已下线)专题六 金属的化学腐蚀与防护(练习)(已下线)不定项选择题
解题方法
2 . 有一包氯化亚铁样品,其中混有少量的AlCl3、FeCl3等杂质,某小组为了提纯氯化亚铁,进行了如下实验。

(1)步骤ii的目的是____________ ,其离子方程式为____________ 。
(2)溶液C中阴离子有____________ ,反应iii的离子反应方程式为____________ 。
(3)根据上述实验,下列哪种说法是不合理 的_______
①溶液B中含有金属离子只有两种
②溶液C中有两种金属阳离子
③固体D加热可分解
(4)根据样品的质量,判断加入1mol/L NaOH溶液的体积合理的为__________ 。
① 40mL ② 400mL ③ 4L

(1)步骤ii的目的是
(2)溶液C中阴离子有
(3)根据上述实验,下列哪种说法是
①溶液B中含有金属离子只有两种
②溶液C中有两种金属阳离子
③固体D加热可分解
(4)根据样品的质量,判断加入1mol/L NaOH溶液的体积合理的为
① 40mL ② 400mL ③ 4L
您最近一年使用:0次
名校
解题方法
3 . 平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵晶体:
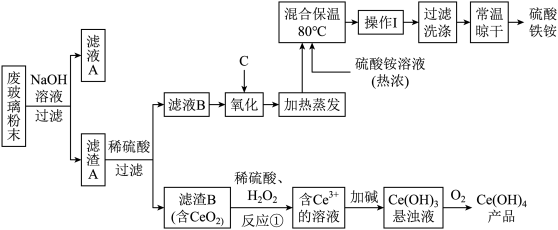
ⅰ.酸性条件下,铈在水溶液中有 、
、 两种主要存在形式,
两种主要存在形式, 易水解,
易水解, 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵晶体广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是_____________。
(2)操作Ⅰ的名称是_____ ,检验硫酸铁铵溶液中含有 的方法是:
的方法是:_______________ 。
(3)反应①之前先要洗涤滤渣B,其目的是为了除去______ (填离子符号);反应①的离子方程式为___________________________________________ 。
(4)用滴定法测定制得的Ce(OH)4产品纯度:

滴定时所用定量仪器的最小刻度为________ ;所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数_________ 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为___________ 。

ⅰ.酸性条件下,铈在水溶液中有
 、
、 两种主要存在形式,
两种主要存在形式, 易水解,
易水解, 有较强氧化性。
有较强氧化性。ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵晶体广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是_____________。
| A.NaClO | B.H2O2 | C.KMnO4 | D.浓硫酸 |
(2)操作Ⅰ的名称是
 的方法是:
的方法是:(3)反应①之前先要洗涤滤渣B,其目的是为了除去
(4)用滴定法测定制得的Ce(OH)4产品纯度:

滴定时所用定量仪器的最小刻度为
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为
您最近一年使用:0次
2016-12-09更新
|
168次组卷
|
2卷引用: 北京市第一六一中学2023-2024学年高二上学期12月份月考化学试卷
真题
名校
4 . 用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
(1)用KSCN溶液检验出Fe3+的现象是_______ 。
(2)I中,Fe2+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式_____ 。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_____ 性。
(4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
①NaCl溶液的浓度是________ mol/L。
②IV中检测Cl2的实验方法:____________________ 。
③与II对比,得出的结论(写出两点):___________________ 。
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)I中,Fe2+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有
(4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
②IV中检测Cl2的实验方法:
③与II对比,得出的结论(写出两点):
您最近一年使用:0次
2016-12-09更新
|
3958次组卷
|
7卷引用:北京市一零一中学2020-2021学年高二上学期期中考试化学试题