名校
1 . 某实验小组对FeCl3溶液与Na2SO3溶液的反应进行探究。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:_______ 。
(2)探究现象ⅰ产生的原因:
①甲同学认为发生反应:2Fe3++3S +6H2O
+6H2O 2Fe(OH)3(胶体)+3H2SO3;
2Fe(OH)3(胶体)+3H2SO3;
他取少量红褐色溶液于试管中,继续滴加1mol/L Na2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是_______ (填化学式)。
②乙同学认为还发生了氧化还原反应,其离子方程式为_______ ;他取少许红褐色溶液于试管中,加入_______ ,有白色沉淀产生,证明产物中含有 .
.
丙同学认为乙同学的实验不严谨,因为在上述过程中 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被氧化的原因,丙同学设计了实验2。
被氧化的原因,丙同学设计了实验2。
【实验2】
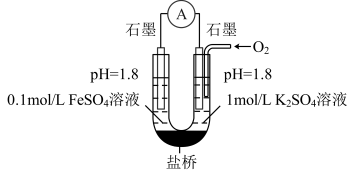
用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。
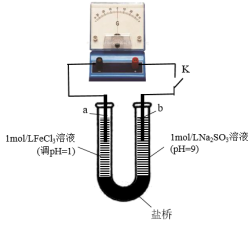
③实验2中正极的电极反应式为_______ 。丙同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是_______ 。
(3)解释现象ⅱ产生的原因:综合上述结果,请从平衡移动角度解释,现象ⅱ产生的原因为_______ 。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
| 装置 | 实验现象 |
 | 现象ⅰ:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ⅱ:一段时间后溶液颜色变浅,变为浅黄色。 |
(2)探究现象ⅰ产生的原因:
①甲同学认为发生反应:2Fe3++3S
 +6H2O
+6H2O 2Fe(OH)3(胶体)+3H2SO3;
2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1mol/L Na2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
②乙同学认为还发生了氧化还原反应,其离子方程式为
 .
.丙同学认为乙同学的实验不严谨,因为在上述过程中
 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被氧化的原因,丙同学设计了实验2。
被氧化的原因,丙同学设计了实验2。【实验2】
用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。

③实验2中正极的电极反应式为
(3)解释现象ⅱ产生的原因:综合上述结果,请从平衡移动角度解释,现象ⅱ产生的原因为
您最近一年使用:0次
2021-01-20更新
|
281次组卷
|
5卷引用:北京市海淀区2020-2021学年高二上学期期末练习化学试题
北京市海淀区2020-2021学年高二上学期期末练习化学试题北京理工大学附属中学2023-2024学年高二上学期12月月考化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)浙江省杭州市源清中学2021-2022学年高二上学期期末考试化学试题湖北省武汉外国语学校2022-2023学年高二上学期第五次阶段性测试化学试题
名校
解题方法
2 . 下列离子在指定的溶液中能够大量共存的是
A.无色溶液中:Fe3+、K+、SCN-、SO |
B.pH=1的溶液中:Na+、Fe2+、Cl-、NO |
C.中性溶液中:K+、Cl-、SO 、NO 、NO |
D.加酚酞呈红色的溶液中:Na+、NH 、Cl-、F- 、Cl-、F- |
您最近一年使用:0次
2021-01-20更新
|
231次组卷
|
4卷引用:北京市海淀区2020-2021学年高二上学期期末练习化学试题
名校
解题方法
3 . 下列反应的离子方程式书写正确的是
A.碳酸钙与稀盐酸反应: |
B.氯化亚铁溶液与氯水反应: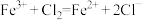 |
C.氯化铁溶液与氢氧化钠溶液反应: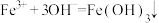 |
D.铜与稀硝酸反应: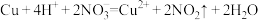 |
您最近一年使用:0次
2020-12-19更新
|
329次组卷
|
2卷引用:2019年北京市普通高中第一次学业水平合格性考试化学试题
解题方法
4 . 钴酸锂(LiCoO2)可用作锂离子电池的电极材料。以红土镍矿为原料制备LiCoO2的工艺流程如图:

已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有__ 。
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是__ 。
②滤渣2的主要成分是__ (写化学式)。
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相) CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)
①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为__ mol/L。

②在__ (填“强碱性”或“强酸性”)介质中反萃取,使萃取剂再生而循环利用。
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是__ 。
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为__ 。
③在空气中烧结反应的化学方程式是__ 。

已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
| 离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
| 开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
| 沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是
②滤渣2的主要成分是
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相)
 CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为

②在
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为
③在空气中烧结反应的化学方程式是
您最近一年使用:0次
5 . 某铜钴矿石主要含有 CoO(OH)、CoCO3、Cu2(OH)2CO3和 SiO2,及一定量的 Fe2O3、MgO 和CaO等。由该矿石制Co2O3的部分工艺流程如图:
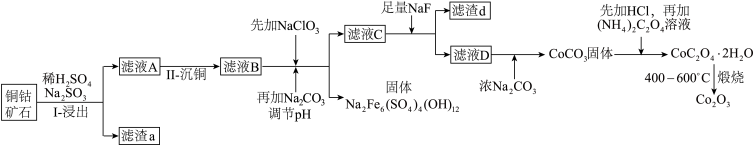
(1)在“浸出”过程中可以提高反应速率的方法有__ 。(写出两种即可)
(2)在“II-沉铜”过程中加入了FeS固体,得到更难溶的CuS,写出该步反应的离子方程式__ 。
(3)NaClO3的主要作用是__ 。
(4)滤渣d 的主要成分是__ 。
(5)滤液D 中加入浓Na2CO3后又加入HCl 溶解,其目的是__ 。
(6)写出CoC2O4·2H2O 在空气中煅烧得到 Co2O3的化学方程式__ 。

(1)在“浸出”过程中可以提高反应速率的方法有
(2)在“II-沉铜”过程中加入了FeS固体,得到更难溶的CuS,写出该步反应的离子方程式
(3)NaClO3的主要作用是
(4)滤渣d 的主要成分是
(5)滤液D 中加入浓Na2CO3后又加入HCl 溶解,其目的是
(6)写出CoC2O4·2H2O 在空气中煅烧得到 Co2O3的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 下列各组离子在水溶液中能大量共存的是
A.H+、Fe2+、 、 、 | B.Na+、OH-、 、 、 |
C.Na+、Al3+、Cl-、 | D.Fe3+、K+、SCN-、Cl- |
您最近一年使用:0次
名校
7 . 已知:K3[Fe(CN)6]溶液是检验Fe2+的试剂,若溶液中存在Fe2+,将产生蓝色沉淀。将0.1mol/L的KI溶液和0.05mol/L Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“”2Fe3++2I- 2Fe2++I2的是
2Fe2++I2的是
 2Fe2++I2的是
2Fe2++I2的是| 实验编号 | 实验操作 | 实验现象 |
| ① | 滴入KSCN溶液 | 溶液变红色 |
| ② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| ③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| ④ | 滴入淀粉溶液 | 溶液变蓝色 |
| A.①和③ | B.②和④ | C.③和④ | D.①和② |
您最近一年使用:0次
2019-11-26更新
|
400次组卷
|
4卷引用:北京师范大学附中2019-2020学年高二上学期期中考试化学试题
北京师范大学附中2019-2020学年高二上学期期中考试化学试题湖北省武汉市汉阳一中2019-2020学年高二9月月考化学试题(已下线)第三章 检测-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)黑龙江省牡丹江市第一高级中学2021-2022学年高二上学期期中考试化学试题
名校
8 . 探究溶液酸碱性对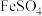 溶液的配制和保存的影响。10mL
溶液的配制和保存的影响。10mL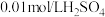 或10mL
或10mL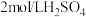 溶液中。
溶液中。
I.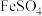 溶液的配制
溶液的配制
将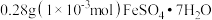 分别溶于10mL蒸馏水或10mL
分别溶于10mL蒸馏水或10mL
(1)用平衡移动原理解释①显酸性的主要原因是________________
(2)②、③变红时发生反应的离子方程式是_______________________
(3)甲同学认为①中一定有+3价铁。他用激光笔照射“溶液”,观察到光路:又向含有KSCN的①中滴入试剂a,溶液变红,说明其推断正确,试剂a是____________
II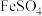 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
【分析讨论】①②说明酸性减弱时,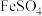 溶液更易变质;②③说明……
溶液更易变质;②③说明……
【查阅资料】在一定pH范围内,+2价铁的还原性随酸性减弱而增强,氧气的氧化性随酸性的增强而增强。
【进行实验】用右图所示装置完成实验(滴加试剂时溶液体积和溶液导电性变化可忽略)。向右池持续稳定通入氧气,待电流表示数稳定后:
I向左池滴加浓硫酸至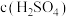 接近
接近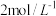 ,电流没有明显变化
,电流没有明显变化
II向右池滴加等量浓硫酸,电流明显增大。
(4)补全【分析讨论】:②③说明_______________
(5)ii中右池的电极反应方程式是____________________
(6)依据实验推断:③比②中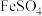 更易变质的原因是
更易变质的原因是___________________
(7)按上述原理及装置重新进行实验证实①中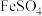 更易变质的原因。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
更易变质的原因。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,____________
(8)依据实验,配制并保存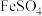 溶液的最佳方法是
溶液的最佳方法是_________________ 。
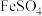 溶液的配制和保存的影响。10mL
溶液的配制和保存的影响。10mL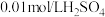 或10mL
或10mL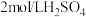 溶液中。
溶液中。I.
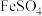 溶液的配制
溶液的配制将
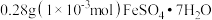 分别溶于10mL蒸馏水或10mL
分别溶于10mL蒸馏水或10mL| 溶液编号 | 溶剂 | 溶液性状 | |
| ① | 蒸馏水 | 浅黄色澄清溶液: | 遇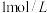  溶液无明显变化 溶液无明显变化 |
| ② | 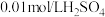 | 无色澄清溶液: | 遇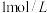  溶液微微变红 溶液微微变红 |
| ③ | 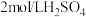 | 无色澄清溶液 | 遇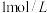  溶液微微变红 溶液微微变红 |
(1)用平衡移动原理解释①显酸性的主要原因是
(2)②、③变红时发生反应的离子方程式是
(3)甲同学认为①中一定有+3价铁。他用激光笔照射“溶液”,观察到光路:又向含有KSCN的①中滴入试剂a,溶液变红,说明其推断正确,试剂a是
II
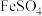 溶液的保存
溶液的保存将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
| 溶液编号 | 溶液性状 | |
| ① | 橙色浑浊 | 用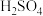 酸化后,浊液变澄清,再滴加5滴 酸化后,浊液变澄清,再滴加5滴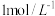 KSCN溶液后变深红 KSCN溶液后变深红 |
| ② | 无色溶液 | 滴加5滴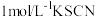 溶液后显浅红色 溶液后显浅红色 |
| ③ | 无色溶液 | 滴加5滴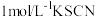 溶液后显红色,颜色比②略深 溶液后显红色,颜色比②略深 |
【分析讨论】①②说明酸性减弱时,
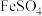 溶液更易变质;②③说明……
溶液更易变质;②③说明……【查阅资料】在一定pH范围内,+2价铁的还原性随酸性减弱而增强,氧气的氧化性随酸性的增强而增强。
【进行实验】用右图所示装置完成实验(滴加试剂时溶液体积和溶液导电性变化可忽略)。向右池持续稳定通入氧气,待电流表示数稳定后:

I向左池滴加浓硫酸至
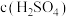 接近
接近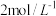 ,电流没有明显变化
,电流没有明显变化II向右池滴加等量浓硫酸,电流明显增大。
(4)补全【分析讨论】:②③说明
(5)ii中右池的电极反应方程式是
(6)依据实验推断:③比②中
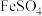 更易变质的原因是
更易变质的原因是(7)按上述原理及装置重新进行实验证实①中
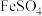 更易变质的原因。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
更易变质的原因。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,(8)依据实验,配制并保存
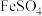 溶液的最佳方法是
溶液的最佳方法是
您最近一年使用:0次
名校
9 . 下列说法不正确 的是
| A.乙醇和浓硫酸反应制乙烯时,利用NaOH溶液可除去杂质气体 |
| B.向饱和Na2CO3溶液中通入足量CO2,可析出NaHCO3,使溶液变浑浊 |
| C.用新制的Cu(OH)2碱性悬浊液可以鉴别甲酸、乙醛、乙酸 |
| D.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
您最近一年使用:0次
名校
10 . 下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质的是
| A.FeSO4 | B.MgSO4 | C.AlCl3 | D.NH4Cl |
您最近一年使用:0次
2018-08-19更新
|
711次组卷
|
6卷引用:【全国区级联考】北京市朝阳区2017-2018学年高二下学期期末考试化学试题
【全国区级联考】北京市朝阳区2017-2018学年高二下学期期末考试化学试题北京市北京医学院附属中学2019-2020学年高二下学期期末考试化学试题北京市第二中学2022-2023学年高二上学期11月月考化学试题河北省唐山市开滦第二中学2019-2020学年高二上学期第二次月考化学试题河北省邯郸市大名县第一中学2019-2020学年高二上学期12月月考化学试题(普通班)(已下线)3.3.2 影响盐类水解的因素(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)



