名校
解题方法
1 . 用硫酸亚铁溶液除去烟气中的 ,主要物质的转化如图,下列说法
,主要物质的转化如图,下列说法不正确 的是
 ,主要物质的转化如图,下列说法
,主要物质的转化如图,下列说法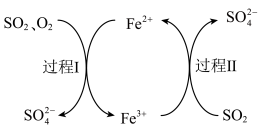
A. 最终转化为 最终转化为 |
B.过程I中, 作氧化剂 作氧化剂 |
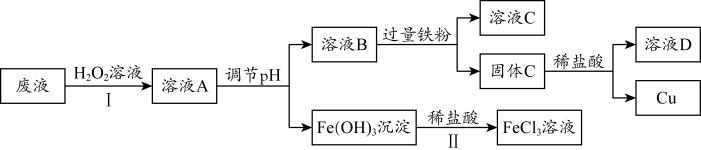
C.过程II中,发生反应: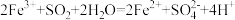 |
D.硫酸亚铁溶液吸收 后,所得的溶液呈碱性 后,所得的溶液呈碱性 |
您最近一年使用:0次
2023-03-15更新
|
1125次组卷
|
7卷引用:2023年北京市第一次普通高中学业水平合格性考试化学试题
解题方法
2 . 工业上用FeCl3溶液作印刷电路铜板的腐蚀液。化学小组设计如下流程对腐蚀废液(阳离子主要有Fe2+、Cu2+、Fe3+和H+)进行处理,实现FeCl3溶液再生并回收Cu。_______ (填“氧化”或“还原”)为Fe3+。
(2)步骤Ⅱ中发生反应的离子方程式为_______ 。
(3)溶液C中含有大量Fe2+。取少量溶液C于试管中,滴加_______ 溶液,有白色沉淀生成,白色沉淀迅速变为灰绿色,最终变为红褐色。
(4)下列说法合理的是_______ (填字母)。
a.溶液A、溶液B和固体C中都含有铜元素
b.溶液C和溶液D可回收利用,体现“绿色化学”理念
(2)步骤Ⅱ中发生反应的离子方程式为
(3)溶液C中含有大量Fe2+。取少量溶液C于试管中,滴加
(4)下列说法合理的是
a.溶液A、溶液B和固体C中都含有铜元素
b.溶液C和溶液D可回收利用,体现“绿色化学”理念
您最近一年使用:0次
3 . 验证牺牲阳极法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确 的是
| ① | ② | ③ |
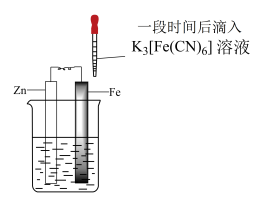 | 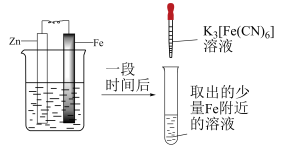 | 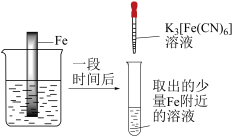 |
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
A.对比①②, 可能将Fe氧化 可能将Fe氧化 |
| B.对比②③,可以判定Zn保护了Fe |
C.用 酸性溶液代替 酸性溶液代替 溶液,也可验证牺牲阳极法 溶液,也可验证牺牲阳极法 |
| D.将Zn换成Cu,用①的方法无法判断Fe比Cu活泼 |
您最近一年使用:0次
2023-01-07更新
|
611次组卷
|
3卷引用:北京师范大学附属中学2022-2023学年上学期高二化学期末试题
解题方法
4 . 下列离子在指定的溶液中能够大量共存的是
A.无色溶液中:Fe3+、K+、 、 、 |
B.中性溶液中:K+、 、 、 、 、 |
C.pH=1的溶液中:Na+、Fe2+、 、 、 |
D.加酚酞呈红色的溶液中:Na+、 、 、 、 、 |
您最近一年使用:0次
名校
5 . 以相同的流速分别向经硫酸酸化和未经酸化的浓度均为0.1mol·L-1的FeSO4溶液中通入O2.溶液中pH随时间的变化如下图所示。
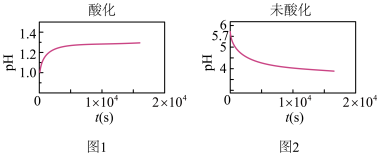
已知:0.1mol·L-1Fe3+生成Fe(OH)3,开始沉淀时pH=1.5,完全沉淀时pH=2.8
下列说法不正确的是

已知:0.1mol·L-1Fe3+生成Fe(OH)3,开始沉淀时pH=1.5,完全沉淀时pH=2.8
下列说法不正确的是
| A.由图1可知,酸化的FeSO4溶液中发生反应:4Fe2++O2+4H+=4Fe3++2H2O |
| B.图2中,t=0时刻,FeSO4溶液pH=5.7是由于Fe2+发生了水解反应 |
| C.由图2可知,未酸化的FeSO4溶液中发生反应生成Fe(OH)3的同时还生成了H+ |
| D.若向FeSO4溶液中先加入过量NaOH溶液再通入O2,pH先增大后明显减小 |
您最近一年使用:0次
2022-05-08更新
|
565次组卷
|
4卷引用:北京汇文中学2023-2024学年高二上学期期中考试化学试题
北京汇文中学2023-2024学年高二上学期期中考试化学试题北京市东城区2022届高三综合练习(二模)化学试题湖南省衡山县岳云中学2021-2022学年高三下学期期中考试化学试卷(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题
名校
6 . 下列化学用语对现象变化的解释不准确的是
A.“NO2球”浸泡在热水中,颜色加深: △H<0 △H<0 |
| B.用石墨电极电解CuSO4溶液,阴极附近溶液蓝色变浅:Cu2++2e-=Cu |
C.向FeSO4溶液中加入Br2水,溶液变为黄色: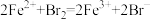 |
D.向Mg(OH)2悬浊液中滴加FeCl3溶液出现红褐色沉淀:3Mg(OH)2(s)+2Fe3+ 2Fe (OH)3(s)+3Mg2+ 2Fe (OH)3(s)+3Mg2+ |
您最近一年使用:0次
2022-02-17更新
|
113次组卷
|
2卷引用:北京市平谷区2021-2022学年高二上学期期末化学试题
名校
7 . 实验中学高二化学某班学生甲、乙小组,分别用实验探究溶液中 、
、 的化学性质回答下列问题:
的化学性质回答下列问题:
(1)将硫酸亚铁溶液滴入硫酸酸化的 溶液中,振荡混合后,溶液中含有
溶液中,振荡混合后,溶液中含有 、
、 等。以下请用离子方程式回答:
等。以下请用离子方程式回答:
①25℃时硫酸亚铁溶液 的原因:
的原因:___________ 。
②请写出硫酸亚铁溶液与硫酸酸化的 溶液反应的原理:
溶液反应的原理:___________ 。
(2)甲组同学取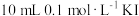 溶液,加入
溶液,加入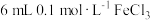 溶液混合。充分反应后,分别取2 mL此溶液于3支试管中进行如下实验:
溶液混合。充分反应后,分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入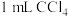 充分振荡、静置,
充分振荡、静置, 层显紫色;
层显紫色;
②第二支试管中加入1滴 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红实验。
②检验的离子是___________ (填离子符号);
实验①和③说明:在 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有___________ (填离子符号),由此可以证明该氧化还原反应为___________ (填可逆反应或不可逆反应)。
(3)乙组同学向盛有 溶液的试管中加入几滴硫酸酸化的硫酸亚铁溶液,溶液变成棕黄色,发生反应的离子方程式为:
溶液的试管中加入几滴硫酸酸化的硫酸亚铁溶液,溶液变成棕黄色,发生反应的离子方程式为:___________ 。一段时间后,溶液中有气泡出现,试管微热,随后有红褐色沉淀生成。产生气泡的原因是___________ 。
 、
、 的化学性质回答下列问题:
的化学性质回答下列问题:(1)将硫酸亚铁溶液滴入硫酸酸化的
 溶液中,振荡混合后,溶液中含有
溶液中,振荡混合后,溶液中含有 、
、 等。以下请用离子方程式回答:
等。以下请用离子方程式回答:①25℃时硫酸亚铁溶液
 的原因:
的原因:②请写出硫酸亚铁溶液与硫酸酸化的
 溶液反应的原理:
溶液反应的原理:(2)甲组同学取
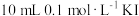 溶液,加入
溶液,加入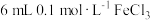 溶液混合。充分反应后,分别取2 mL此溶液于3支试管中进行如下实验:
溶液混合。充分反应后,分别取2 mL此溶液于3支试管中进行如下实验:①第一支试管中加入
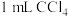 充分振荡、静置,
充分振荡、静置, 层显紫色;
层显紫色;②第二支试管中加入1滴
 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;③第三支试管中加入1滴KSCN溶液,溶液变红实验。
②检验的离子是
实验①和③说明:在
 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有(3)乙组同学向盛有
 溶液的试管中加入几滴硫酸酸化的硫酸亚铁溶液,溶液变成棕黄色,发生反应的离子方程式为:
溶液的试管中加入几滴硫酸酸化的硫酸亚铁溶液,溶液变成棕黄色,发生反应的离子方程式为:
您最近一年使用:0次
名校
解题方法
8 . 某实验小组同学用KSCN探究久置 固体变质的情况。将0.3 g
固体变质的情况。将0.3 g  固体用10mL蒸馏水溶解,配成待测液,进行实验。
固体用10mL蒸馏水溶解,配成待测液,进行实验。
【初步实验】
(1)用KSCN检验 的原理是
的原理是___________ (用离子方程式表示)。
(2)甲同学认为 固体几乎未变质,ⅱ中变血红色是由于
固体几乎未变质,ⅱ中变血红色是由于 被氧化,反应的离子方程式为
被氧化,反应的离子方程式为___________ ;ⅱ中血红色褪去的可能原因是___________ 。
(3)乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是___________ 。
【继续探究】
(4)请补全步骤Ⅱ中的操作:___________ 。
(5)由Ⅰ~Ⅲ推测 固体变质的情况是
固体变质的情况是___________ (填字母序号),理由是___________ 。
a.几乎未变质 b.部分变质 c.完全变质
【反思与迁移】
(6)从上述探究中获得启发,在用KSCN检验 及进行
及进行 还原性验证实验时,需要注意的事项有
还原性验证实验时,需要注意的事项有___________ (至少2条)。
 固体变质的情况。将0.3 g
固体变质的情况。将0.3 g  固体用10mL蒸馏水溶解,配成待测液,进行实验。
固体用10mL蒸馏水溶解,配成待测液,进行实验。【初步实验】

(1)用KSCN检验
 的原理是
的原理是(2)甲同学认为
 固体几乎未变质,ⅱ中变血红色是由于
固体几乎未变质,ⅱ中变血红色是由于 被氧化,反应的离子方程式为
被氧化,反应的离子方程式为(3)乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是
【继续探究】
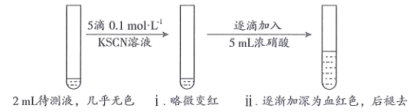
| 步骤 | 操作 | 现象 |
| Ⅰ | 取2mL待测液,加入5滴0.1 KSCN溶液,再加入5mL浓 KSCN溶液,再加入5mL浓 溶液 溶液 | 溶液颜色无明显变化 |
| Ⅱ | 取2mL待测液, | 溶液变为红色 |
| Ⅲ | 向Ⅱ中所得溶液中逐滴加入5mL浓硝酸,边加边振荡 | 溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显 |
(5)由Ⅰ~Ⅲ推测
 固体变质的情况是
固体变质的情况是a.几乎未变质 b.部分变质 c.完全变质
【反思与迁移】
(6)从上述探究中获得启发,在用KSCN检验
 及进行
及进行 还原性验证实验时,需要注意的事项有
还原性验证实验时,需要注意的事项有
您最近一年使用:0次
2021-11-04更新
|
745次组卷
|
6卷引用:北京市和平街第一中学2023-2024学年高二上学期期中考试化学试题
北京市和平街第一中学2023-2024学年高二上学期期中考试化学试题北京市海淀区2021-2022学年高三上学期期中考试化学试题北京市第二十二中学2021-2022学年高三上学期期中考试化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市首都师范大学附属密云中学2022-2023学年高三上学期10月阶段性练习化学试题(已下线)微专题13 亚铁离子、三价铁离子的性质及检验-备战2023年高考化学一轮复习考点微专题
解题方法
9 . 以下物质混合不能发生离子反应的是
| A.CH3COONa 溶液与 HCl 溶液 | B.MgCO3 沉淀与 NaOH 溶液 |
| C.FeCl2 溶液与 KMnO4溶液 | D.Na2CO3 溶液与 KOH 溶液 |
您最近一年使用:0次
名校
解题方法
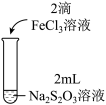
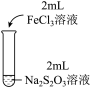
10 . 某实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
资料:ⅰ.Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ⅱ.Fe3++ ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象
(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:_______ 。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到_______ 。
②实验I中紫色褪去时 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是_______ 。
③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是_______ 。
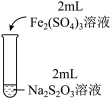
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是_______ 。
②由实验Ⅳ和实验Ⅴ得出的结论是_______ 。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
| 实验编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验操作 |
|
|
|
| 实验现象 | 溶液呈紫色, 静置后紫色迅速褪去, 久置后出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色褪去, 久置后不出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色缓慢褪去, 久置后不出现淡黄色浑浊 |
ⅱ.Fe3++
 ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到
②实验I中紫色褪去时
 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | Ⅳ | Ⅴ |
| 实验操作 | 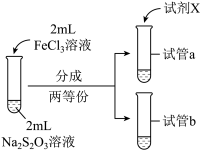 |  |
| 实验现象 | 紫色褪去时间a>b | 紫色褪去时间c<d |
②由实验Ⅳ和实验Ⅴ得出的结论是
您最近一年使用:0次
2021-01-20更新
|
1043次组卷
|
7卷引用:北京市清华大学附属中学2022-2023学年高二上学期期末化学试题
北京市清华大学附属中学2022-2023学年高二上学期期末化学试题北京市东城区2021届高三上学期期末教学统一检测化学试题北京理工大学附属中学2023-2024学年高三上学期10月月考化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练辽宁省葫芦岛市2021届高考第一次模拟考试化学试题