名校
1 . Ⅷ族元素铁及其化合物性质多样,大多发生氧化还原反应。
(1)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为 Fe3+。请配平如下制取高铁酸钠的化学方程式,并标明电子转移方向和数目:____ ,____Fe(NO3)3 +_____NaOH +____Cl2 →____Na2FeO4+____NaNO3+____NaCl +_____H2O
(2)在如图所示的装置中,用 NaOH 溶液、铁粉、稀 H2SO4等试剂制备氢氧化亚铁。

①仪器 a 的名称是___________ 。
②关闭K3,打开 K1和K2,向仪器 c 中加入适量稀硫酸,关闭 K2, 写出装置c 中发生反应的离子方程式___________ 。同时c 中有气体产生,该气体的作用是___________ 。当仪器b 中产生均匀气泡后的操作是___________ 。写出仪器c、d 中可能出现的实验现象___________ 。
(3)已知SO2+2Fe3++2H2O=4H++ +2Fe2+。向2支试管中各加入5 mL1.0mol⋅L−1 FeCl3溶液,若直接通入 SO2至饱和,1 小时后,溶液逐渐变为浅绿色;若先滴加 2 滴浓盐酸,再通入 SO2至饱和,几分钟后,溶液由黄色变为浅绿色。由此可知:促使该氧化还原反应快速发生,可采取的措施是
+2Fe2+。向2支试管中各加入5 mL1.0mol⋅L−1 FeCl3溶液,若直接通入 SO2至饱和,1 小时后,溶液逐渐变为浅绿色;若先滴加 2 滴浓盐酸,再通入 SO2至饱和,几分钟后,溶液由黄色变为浅绿色。由此可知:促使该氧化还原反应快速发生,可采取的措施是___________ 。
(4)过量铁粉与硝酸银溶液反应,。向pH=4 的 0.1mol/L 的AgNO3溶液中加入过量铁粉,搅拌后静置,在不同时间取上层清液,滴加KSCN 溶液,溶液颜色、沉淀量与取样时间有关,对比实验记录如下:
①用离子方程式解释实验中ⅰ出现红色原因:Fe + 2Ag+= Fe2+ + 2Ag,___________ , Fe3+ + 3SCN- = Fe(SCN)3。
②白色沉淀为少量银和硫氰化银;ⅲ中溶液红色较 30min 时变浅的原因是__________ 。
(1)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为 Fe3+。请配平如下制取高铁酸钠的化学方程式,并标明电子转移方向和数目:
(2)在如图所示的装置中,用 NaOH 溶液、铁粉、稀 H2SO4等试剂制备氢氧化亚铁。

①仪器 a 的名称是
②关闭K3,打开 K1和K2,向仪器 c 中加入适量稀硫酸,关闭 K2, 写出装置c 中发生反应的离子方程式
(3)已知SO2+2Fe3++2H2O=4H++
 +2Fe2+。向2支试管中各加入5 mL1.0mol⋅L−1 FeCl3溶液,若直接通入 SO2至饱和,1 小时后,溶液逐渐变为浅绿色;若先滴加 2 滴浓盐酸,再通入 SO2至饱和,几分钟后,溶液由黄色变为浅绿色。由此可知:促使该氧化还原反应快速发生,可采取的措施是
+2Fe2+。向2支试管中各加入5 mL1.0mol⋅L−1 FeCl3溶液,若直接通入 SO2至饱和,1 小时后,溶液逐渐变为浅绿色;若先滴加 2 滴浓盐酸,再通入 SO2至饱和,几分钟后,溶液由黄色变为浅绿色。由此可知:促使该氧化还原反应快速发生,可采取的措施是(4)过量铁粉与硝酸银溶液反应,。向pH=4 的 0.1mol/L 的AgNO3溶液中加入过量铁粉,搅拌后静置,在不同时间取上层清液,滴加KSCN 溶液,溶液颜色、沉淀量与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 实验现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀,较 3min 时量少;溶液红色较 3min 时加深 |
| ⅲ | 120 | 产生白色沉淀,较 30min 时量少;溶液红色较 30min 时变浅 |
②白色沉淀为少量银和硫氰化银;ⅲ中溶液红色较 30min 时变浅的原因是
您最近一年使用:0次
名校
解题方法
2 . 下列关于Fe3+、Fe2+性质实验的说法错误的是( )


| A.用如图装置可以制备Fe(OH)2沉淀 |
| B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 |
| C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+ |
| D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
您最近一年使用:0次
2016-12-09更新
|
478次组卷
|
16卷引用:上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题
上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题2015-2016学年河北保定一中高二下期末化学试卷【全国百强校】甘肃省静宁县第一中学2019届高三上学期第一次模拟考试化学试题黑龙江省齐齐哈尔市第八中学2019届高三9月月考化学试题河北省邯郸市大名县第一中学2019-2020学年高二下学期第一次半月考化学试题安徽省滁州市定远县民族中学2020-2021学年高一11月月考化学试题安徽省滁州市定远育才学校2021-2022学年高二上学期开学摸底考试化学试题江西省安福中学2021-2022学年高二上学期开学考试化学(理)试题安徽省滁州市定远县育才学校2021-2022学年高一上学期月考化学试题宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题天津市实验中学滨海学校黄南民族班2021-2022学年高三上学期期中质量监测化学试题辽宁省大石桥市第三高级中学2021-2022学年高一12月月考化学试题(已下线)第3讲 铁盐及其亚铁盐陕西省西安市铁一中学2023-2024学年高三上学期9月月考化学试题
名校
解题方法
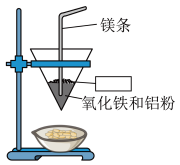
3 . 将铝与氧化铁混合制备单质铁的反应称为铝热反应,反应装置如图所示:_____ 。
(2)该铝热反应的化学方程式为_____ ,引发铝热反应的实验操作是_____ 。
(3)取少量反应所得的固体混合物,将其溶于足量稀 ,滴加KSCN溶液无明显现象,能否说明固体混合物中已无
,滴加KSCN溶液无明显现象,能否说明固体混合物中已无 ,请判断并说明理由
,请判断并说明理由_____ 。
(4)写出一种铝热反应的实际应用_____ 。
(2)该铝热反应的化学方程式为
(3)取少量反应所得的固体混合物,将其溶于足量稀
 ,滴加KSCN溶液无明显现象,能否说明固体混合物中已无
,滴加KSCN溶液无明显现象,能否说明固体混合物中已无 ,请判断并说明理由
,请判断并说明理由(4)写出一种铝热反应的实际应用
您最近一年使用:0次
名校
解题方法
4 . 草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
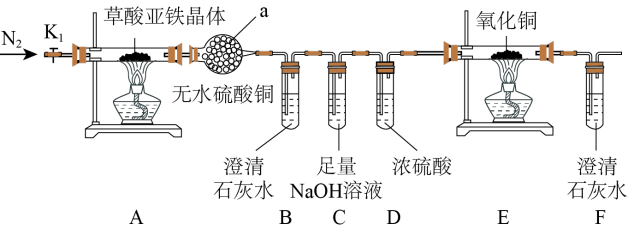
(1)仪器a的名称是______ 。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________ 。
(3)实验前先通入一段时间N2,其目的为__________ 。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____ 。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
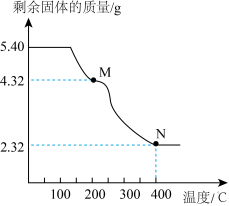
①上图中M点对应物质的化学式为_________ 。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______ 。

(1)仪器a的名称是
(2)从绿色化学考虑,该套装置存在的明显缺陷是
(3)实验前先通入一段时间N2,其目的为
(4)实验证明了气体产物中含有CO,依据的实验现象为
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:

①上图中M点对应物质的化学式为
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:
您最近一年使用:0次
2020-03-15更新
|
1056次组卷
|
7卷引用:上海大学附属中学2021-2022学年学高三下学期第一次测试化学试题
5 . 氢溴酸是无色、易挥发的液体,在化工领域用途广泛。实验室模拟一种工业制备氢溴酸的主要流程如下:

(1)写出反应①的离子方程式___________ 该反应需要在冰水浴中进行,可能的原因是____________ 。
(2)操作I的名称__________ 。
(3)反应②中Na2SO3的目的是_____________________ 。
(4)操作Ⅱ用到的玻璃仪器有烧杯、_____________________ 。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_________ ,若假设成立可观察到的现象为____________________ 。
②乙同学假设工业氢溴酸呈淡黄色是因为____ ,其用于证明该假设成立的方法为________________ 。

(1)写出反应①的离子方程式
(2)操作I的名称
(3)反应②中Na2SO3的目的是
(4)操作Ⅱ用到的玻璃仪器有烧杯、
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为
②乙同学假设工业氢溴酸呈淡黄色是因为
您最近一年使用:0次
名校
6 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:
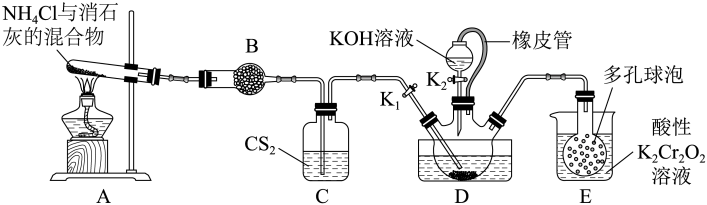
已知:①CS2不溶于水,密度比水的大;②NH3不溶于CS2;③三颈烧瓶内盛放有CS2、水和催化剂。
回答下列问题:
(1)制备NH4SCN溶液:
①实验开始时,打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应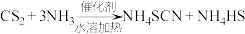 ,该反应比较缓慢,反应至CS2消失。
,该反应比较缓慢,反应至CS2消失。
②装置C的主要作用是_____ ,三颈烧瓶的下层CS2液体必须浸没导气管口,主要原因是_____ 。
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1和K2,移开水浴,将装置D继续加热至105℃,NH4HS完全分解后( ),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为_____ 。
②装置E的作用除可以吸收NH3外,还能吸收产生的_____ 。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、_____ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液,量取20.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000 mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00 mL。
①滴定时发生的反应: (白色)则判断到达滴定终点时溶液颜色的变化为
(白色)则判断到达滴定终点时溶液颜色的变化为_____ 。
②晶体中KSCN的质量分数为_____ 。(计算结果精确至0.1%)。

已知:①CS2不溶于水,密度比水的大;②NH3不溶于CS2;③三颈烧瓶内盛放有CS2、水和催化剂。
回答下列问题:
(1)制备NH4SCN溶液:
①实验开始时,打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应
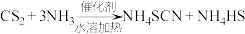 ,该反应比较缓慢,反应至CS2消失。
,该反应比较缓慢,反应至CS2消失。②装置C的主要作用是
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1和K2,移开水浴,将装置D继续加热至105℃,NH4HS完全分解后(
 ),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为②装置E的作用除可以吸收NH3外,还能吸收产生的
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、
(4)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液,量取20.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000 mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00 mL。
①滴定时发生的反应:
 (白色)则判断到达滴定终点时溶液颜色的变化为
(白色)则判断到达滴定终点时溶液颜色的变化为②晶体中KSCN的质量分数为
您最近一年使用:0次



