名校
1 . 下列关于实验现象的解释或所得结论正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某补血口服液中滴加酸性 溶液 溶液 | 酸性 溶液紫色褪去 溶液紫色褪去 | 该补血口服液中一定含有 |
| B | 向饱和 溶液中滴加一定量的浓 溶液中滴加一定量的浓 溶液 溶液 | 溶液变浑浊同时产生气泡 | 发生反应: |
| C | 向 溶液中滴加几滴 溶液中滴加几滴 溶液,观察现象,再滴加氯水直至过量 溶液,观察现象,再滴加氯水直至过量 | 开始无现象,加入氯水后溶液变红,过量后红色消失 | 氯水具有氧化性和漂白性 |
| D | 向 的水溶液中滴加硝酸银溶液 的水溶液中滴加硝酸银溶液 | 无明显现象 | 该配合物中 的配位数是6 的配位数是6 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-05更新
|
350次组卷
|
2卷引用:山东省济宁市兖州区2023-2024学年高三上学期期中考试化学试题
2 . 亚硝酸钠 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某学习小组制备亚硝酸钠并探究其性质。
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某学习小组制备亚硝酸钠并探究其性质。
实验一:制备
该小组查阅资料: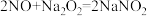 ,
,
制备装置如图所示(夹持装置略去):

(1)写出A中发生反应的离子方程式___________ 。
(2)甲同学检查完装置气密性良好后进行实验,发现制得的 中混有较多的
中混有较多的 杂质。为了提高了
杂质。为了提高了 的纯度,可采取的改进措施是
的纯度,可采取的改进措施是___________ 。
(3)装置D可将剩余的NO氧化成 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
实验二:以亚硝酸钠溶液为研究对象,探究 的性质。
的性质。
资料: 在溶液中呈棕色。
在溶液中呈棕色。
(4)结合化学用语解释实验①“微热后红色加深”的原因___________ 。
(5)解释实验④中“溶液变黄后迅速变为棕色”的原因___________ (用离子方程式表示)。
(6)取一支试管,加入少量实验④中的棕色溶液,加热,有无色气体逸出,在近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因___________ 。
 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某学习小组制备亚硝酸钠并探究其性质。
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某学习小组制备亚硝酸钠并探究其性质。实验一:制备

该小组查阅资料:
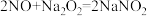 ,
,
制备装置如图所示(夹持装置略去):

(1)写出A中发生反应的离子方程式
(2)甲同学检查完装置气密性良好后进行实验,发现制得的
 中混有较多的
中混有较多的 杂质。为了提高了
杂质。为了提高了 的纯度,可采取的改进措施是
的纯度,可采取的改进措施是(3)装置D可将剩余的NO氧化成
 ,发生反应的离子方程式为
,发生反应的离子方程式为实验二:以亚硝酸钠溶液为研究对象,探究
 的性质。
的性质。| 实验 | 实验编号 | 试剂 | 现象 | |
| 滴管 | 试管 | |||
 | ① | 1%酚酞溶液 |  溶液 溶液 | 溶液变为浅红色,微热后红色加深 |
| ② |  溶液 溶液 |  溶液 溶液 | 开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
| ③ |  溶液 溶液 |  溶液 溶液 | 无明显变化 | |
| ④ |  溶液 溶液 |  溶液 溶液 | 溶液变黄后迅速变为棕色,再滴加KSCN溶液变红 | |
 在溶液中呈棕色。
在溶液中呈棕色。(4)结合化学用语解释实验①“微热后红色加深”的原因
(5)解释实验④中“溶液变黄后迅速变为棕色”的原因
(6)取一支试管,加入少量实验④中的棕色溶液,加热,有无色气体逸出,在近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因
您最近一年使用:0次
2021-04-19更新
|
739次组卷
|
5卷引用:押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)
(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)北京市门头沟区2021届高三一模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(01)(已下线)押全国卷理综第26题 实验综合-备战2021年高考化学临考题号押题(课标全国卷)2020年北京高考化学真题变式题11-19
2021·安徽马鞍山·一模
3 . 蛭石是一种铝硅酸盐(不溶于稀酸、碱),加热后体积会增大为原体积的60倍,具有理想的保温及涵水功能,是种植业的优良基质材料。一种“暖宝宝”内充Fe粉、蛭石粉、活性炭、NaCl固体和吸水性树脂,使用时去掉不透气的外包装使透气内袋暴露在空气中,即可发热至53℃左右。某化学兴趣小组设计了以下实验,探究已使用过的“暖宝宝”成分、回收蛭石,并制备“引火铁”(一种抛撒到空气中即可自燃的超细铁粉)。
【实验方案】
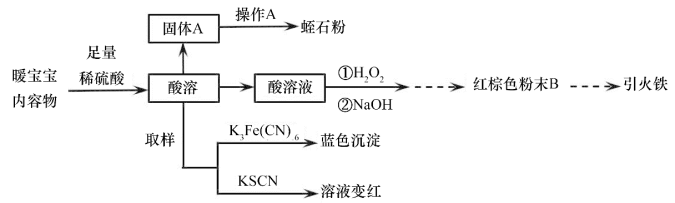
【实验装置】(制引火铁)
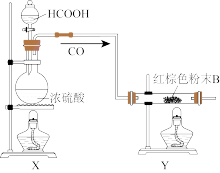
回答下列问题:
(1)在“暖宝宝”的使用过程中,蛭石粉的作用是_______ 。影响“暖宝宝”发热的持续时间和温度的主要因素是_______ 。
(2)“实验方案”中“操作A”的具体内容为_______ 。
(3)有关使用后的“暖宝宝”中铁元素的存在形式,下列说法正确的是_______ 。
A.一定含有Fe、Fe2+、Fe3+ B.一定含Fe3+ C.一定含有Fe2+、Fe3+ D.可能含Fe
(4)制引火铁的“实验装置”中有两处明显的缺陷,分别是_______ 和_______ 。
(5)制取CO时,浓硫酸的作用是_______ 。实验开始时,应先点燃_______ (填“X”或“Y”)处酒精灯。
(6)“引火铁”在空气中能自燃的原因是_______ 。
【实验方案】

【实验装置】(制引火铁)

回答下列问题:
(1)在“暖宝宝”的使用过程中,蛭石粉的作用是
(2)“实验方案”中“操作A”的具体内容为
(3)有关使用后的“暖宝宝”中铁元素的存在形式,下列说法正确的是
A.一定含有Fe、Fe2+、Fe3+ B.一定含Fe3+ C.一定含有Fe2+、Fe3+ D.可能含Fe
(4)制引火铁的“实验装置”中有两处明显的缺陷,分别是
(5)制取CO时,浓硫酸的作用是
(6)“引火铁”在空气中能自燃的原因是
您最近一年使用:0次
2021-03-12更新
|
1036次组卷
|
4卷引用:重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)
(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)安徽省马鞍山市2021届高三第一次模拟理综化学试题河南省豫南省级示范高中联盟2021-2022学年高三下学期考前模拟三理科综合化学试题(已下线)专题十八化学实验综合题解题策略
解题方法
4 . Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。回答下列问题:

(1)“滤渣1”的成分为______ (写化学式)。
(2)“除铁”中,加入NaClO的目的是_________________ ,为了证明加入NaClO已足量,可选择的试剂是__________ (填字母标号)。
a.KSCN溶液、氯水 b.K3[Fe(CN)6] 溶液 c.NaOH溶液
(3)已知“滤渣2”的成分为黄钠铁矾,其化学式为NaFe3(SO4)2(OH)6,则“除铁”
中“Na2CO3/△”条件下生成滤渣2的离子方程式为_______________ 。
(4)“除镁”中,若溶液pH过小,Mg2+沉淀不完全,原因是_____________ 。
(5)“沉镍”的离子方程式为__________ 。
(6)以镍钴锰三元材料(可简写为Li1-nMO2)为一极电极材料的新型锂电池工作原理如图所示,放电时总反应为Li1-nMO2+LinC6 LiMO2+6C,则充电时b极的电极反应式为
LiMO2+6C,则充电时b极的电极反应式为____________________ 。


(1)“滤渣1”的成分为
(2)“除铁”中,加入NaClO的目的是
a.KSCN溶液、氯水 b.K3[Fe(CN)6] 溶液 c.NaOH溶液
(3)已知“滤渣2”的成分为黄钠铁矾,其化学式为NaFe3(SO4)2(OH)6,则“除铁”
中“Na2CO3/△”条件下生成滤渣2的离子方程式为
(4)“除镁”中,若溶液pH过小,Mg2+沉淀不完全,原因是
(5)“沉镍”的离子方程式为
(6)以镍钴锰三元材料(可简写为Li1-nMO2)为一极电极材料的新型锂电池工作原理如图所示,放电时总反应为Li1-nMO2+LinC6
 LiMO2+6C,则充电时b极的电极反应式为
LiMO2+6C,则充电时b极的电极反应式为
您最近一年使用:0次
5 . 某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
【甲同学的实验】
(1)怎样配制FeCl3溶液? ________________________________________________________ 。
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入_________________________________ ,产生白色沉淀,证明产生了SO42-。
② 该同学又设计实验探究另一电极的产物,其实验方案为_______________________________ 。
(3)实验I中负极的电极反应式为______________________________________________________ 。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3- Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②_____________________________________________ 。
(5)查阅资料:溶液中Fe3+、SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________________________ 。
【实验反思】
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和______________________ 有关(写出两条)。
【甲同学的实验】
| 装置 | 编号 | 试剂X | 实验现象 |
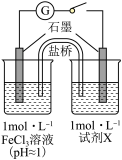 | I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
| II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入
② 该同学又设计实验探究另一电极的产物,其实验方案为
(3)实验I中负极的电极反应式为
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
| 装置 | 编号 | 反应时间 | 实验现象 |
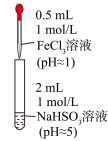 | III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
| 30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
① Fe3++3HSO3-
 Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②(5)查阅资料:溶液中Fe3+、SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:
【实验反思】
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和
您最近一年使用:0次
2020-03-28更新
|
363次组卷
|
2卷引用:山东潍坊市高密一中2020届高三3月份高考模拟化学试题
6 . 将过量的0.2g铜粉与5mL1 mol•L‾1FeCl3溶液混合,充分振荡,溶液棕黄色变浅,溶液变绿,有灰白色固体出现。通过查阅资料,初步认为灰白色固体可能含CuCl(CuCl白色晶体,不溶于水、硫酸、稀硝酸,溶于氨水、浓盐酸溶液中,生成络合物)。为进一步探究灰白色固体是否含CuCl,进行一系列实验。已知:① CuCl+2NH3•H2O [Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
请回答下列问题:
(1)生成CuCl的化学方程式____________________________________ 。
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是_______________ 。
A.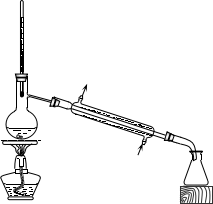 B.
B. 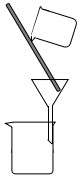 C.
C. D.
D. E.
E. F.
F.
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl‾。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有_______ (填离子符号),理由是_____________________________________________ 。
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为____________________ 。
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是____________ (列出计算式即可)。
 [Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液请回答下列问题:
(1)生成CuCl的化学方程式
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是
A.
 B.
B.  C.
C. D.
D. E.
E. F.
F.
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl‾。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是
您最近一年使用:0次



