1 . 金属铝质轻且具有良好的抗腐蚀性,在日常生活与工业生产中有非常重要的作用。请回答下列问题:
(1)31号元素镓(Ga)与铝同主族。镓的原子结构示意图为___________ ,写出金属镓与盐酸反应的化学方程式:___________ 。铍的单质、化合物与铝的单质、化合物分别具有相似的化学性质,写出 溶液与过量NaOH溶液反应的离子方程式:
溶液与过量NaOH溶液反应的离子方程式:___________ 。
(2)人类最早使用的金属材料的主要成分是铜。下列说法中正确的是___________(填字母)。
(3)向稀 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为(用化学式表示)
恰好完全沉淀,此时铝元素的存在形式主要为(用化学式表示)___________ 。
(4)某同学对铝与 发生铝热反应的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。
发生铝热反应的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。
①上述置换反应的化学方程式为___________ 。
②该同学推测铝热反应得到的熔融物中还含有 ,他设计了如下方案来验证:取一块该熔融物,冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含
,他设计了如下方案来验证:取一块该熔融物,冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含 。该同学的实验方案是否合理?
。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由是___________ 。
(1)31号元素镓(Ga)与铝同主族。镓的原子结构示意图为
 溶液与过量NaOH溶液反应的离子方程式:
溶液与过量NaOH溶液反应的离子方程式:(2)人类最早使用的金属材料的主要成分是铜。下列说法中正确的是___________(填字母)。
| A.青铜和黄铜均是合金 | B.铜表面易形成致密的氧化膜 |
C.铜绿[ ]属于碱式盐 ]属于碱式盐 | D.金属铜能与 溶液发生置换反应 溶液发生置换反应 |
 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为(用化学式表示)
恰好完全沉淀,此时铝元素的存在形式主要为(用化学式表示)(4)某同学对铝与
 发生铝热反应的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。
发生铝热反应的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。①上述置换反应的化学方程式为
②该同学推测铝热反应得到的熔融物中还含有
 ,他设计了如下方案来验证:取一块该熔融物,冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含
,他设计了如下方案来验证:取一块该熔融物,冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含 。该同学的实验方案是否合理?
。该同学的实验方案是否合理?
您最近一年使用:0次
2 . “氢分子沐足机”养生骗局:2022年央视曾曝光一起:“氢分子沐足机”养生骗局。商家称该机器能帮助身体排毒,并生成氢气抗衰老。将机器接通电源,观察到有气泡生成,机器底部不断产生红色的“毒素”沉淀。为了探究该机器的原理,某科学实验小组进行了探究:
(1)该科学小组采用原子发射光谱法确定了气体为氢气。以下现象与原子发射光谱原理相同的是___________。
A.焰色试验 B.白光透过光栅时产生不同颜色的光 C.滴定管液面处蓝线粗细不同
(2)该科学小组采用了X射线射法确定所谓“毒素”其实是 。有关X射线衍射法,下列说法不正确的是___________。
。有关X射线衍射法,下列说法不正确的是___________。
(3)该科学小组还利用化学方法辅助鉴定毒素成分以确定毒素确为 。取少量“毒素”样品,加入稀盐酸溶解,和
。取少量“毒素”样品,加入稀盐酸溶解,和 溶液,出现血红色,证明毒素样品中含
溶液,出现血红色,证明毒素样品中含 ,请写出溶液变为血红色的离子反应方程式
,请写出溶液变为血红色的离子反应方程式___________ 。
(4)除 溶液外,还可以使用亚铁氰化钾
溶液外,还可以使用亚铁氰化钾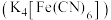 溶液鉴别
溶液鉴别 ,现象为生成蓝色沉淀
,现象为生成蓝色沉淀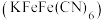 。
。 可由向
可由向 溶液中加入
溶液中加入 溶液制得。该反应开始时生成白色沉淀
溶液制得。该反应开始时生成白色沉淀 ,后白色沉淀溶解并析出晶体
,后白色沉淀溶解并析出晶体 ,请写出白色沉淀溶解析出晶体的离子方程式
,请写出白色沉淀溶解析出晶体的离子方程式___________ 。
(5) 是一种配位化合物,其配位数及配离子的空间构型为___________。
是一种配位化合物,其配位数及配离子的空间构型为___________。
(6)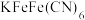 判断化合物中第一个
判断化合物中第一个 的化合价___________。
的化合价___________。
(7) 中,除了配位键外还存在
中,除了配位键外还存在___________ 键和___________ 键。
(8)若向题(3)中血红色溶液中加入 溶液,会观察到血红色褪去,生成
溶液,会观察到血红色褪去,生成 。请从配位键的强弱与离子反应发生条件角度说明为何该反应可以发生。
。请从配位键的强弱与离子反应发生条件角度说明为何该反应可以发生。___________
(9)经检测,该装置其实是一个电解装置,使用时,先向水中加入一勺食盐。请根据毒素成分及生成氢气,阴极材料选择惰性电极,阳极材料可选择___________ 。
(10)该装置的阳极反应为___________ 。
(11) 没有参与反应,请分析
没有参与反应,请分析 在整个装置中起到的作用
在整个装置中起到的作用___________ 。
(12)沐足机在使用过程中,铁质把手容易生锈。请提出一条缓解把手生锈的建议___________ 。
(13)该沐足机在维修时,内部电路正负极接反了,会造成严重的安全隐患,请结合方程式和文字描述可能出现的隐患___________ 。

(1)该科学小组采用原子发射光谱法确定了气体为氢气。以下现象与原子发射光谱原理相同的是___________。
A.焰色试验 B.白光透过光栅时产生不同颜色的光 C.滴定管液面处蓝线粗细不同
(2)该科学小组采用了X射线射法确定所谓“毒素”其实是
 。有关X射线衍射法,下列说法不正确的是___________。
。有关X射线衍射法,下列说法不正确的是___________。| A.X射线衍射法可以确定晶胞大小和形状 | B.X射线衍射法可以确定晶胞中的原子种类 |
| C.X射线衍射法可以确定晶胞中原子的位置排列 | D.X射线衍射法可能会损伤样品 |
 。取少量“毒素”样品,加入稀盐酸溶解,和
。取少量“毒素”样品,加入稀盐酸溶解,和 溶液,出现血红色,证明毒素样品中含
溶液,出现血红色,证明毒素样品中含 ,请写出溶液变为血红色的离子反应方程式
,请写出溶液变为血红色的离子反应方程式(4)除
 溶液外,还可以使用亚铁氰化钾
溶液外,还可以使用亚铁氰化钾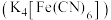 溶液鉴别
溶液鉴别 ,现象为生成蓝色沉淀
,现象为生成蓝色沉淀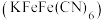 。
。 可由向
可由向 溶液中加入
溶液中加入 溶液制得。该反应开始时生成白色沉淀
溶液制得。该反应开始时生成白色沉淀 ,后白色沉淀溶解并析出晶体
,后白色沉淀溶解并析出晶体 ,请写出白色沉淀溶解析出晶体的离子方程式
,请写出白色沉淀溶解析出晶体的离子方程式(5)
 是一种配位化合物,其配位数及配离子的空间构型为___________。
是一种配位化合物,其配位数及配离子的空间构型为___________。| A.2,直线形 | B.3,平面三角形 | C.4,四面体形 | D.6,八面体形 |
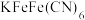 判断化合物中第一个
判断化合物中第一个 的化合价___________。
的化合价___________。| A.0价 | B. | C. | D. |
 中,除了配位键外还存在
中,除了配位键外还存在(8)若向题(3)中血红色溶液中加入
 溶液,会观察到血红色褪去,生成
溶液,会观察到血红色褪去,生成 。请从配位键的强弱与离子反应发生条件角度说明为何该反应可以发生。
。请从配位键的强弱与离子反应发生条件角度说明为何该反应可以发生。(9)经检测,该装置其实是一个电解装置,使用时,先向水中加入一勺食盐。请根据毒素成分及生成氢气,阴极材料选择惰性电极,阳极材料可选择
(10)该装置的阳极反应为
(11)
 没有参与反应,请分析
没有参与反应,请分析 在整个装置中起到的作用
在整个装置中起到的作用(12)沐足机在使用过程中,铁质把手容易生锈。请提出一条缓解把手生锈的建议
(13)该沐足机在维修时,内部电路正负极接反了,会造成严重的安全隐患,请结合方程式和文字描述可能出现的隐患

您最近一年使用:0次
3 . 中国“奋斗号”载人潜水器在马里亚纳海沟成功坐底深度10909米,挑战了全球海洋最深处。国产新型钛合金、能源供给锂电池等功不可没。磷酸亚铁锂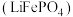 可作为锂电池的正极材料,请回答下列问题:
可作为锂电池的正极材料,请回答下列问题:
(1)潜水器外壳使用的钛合金不可能具有的性质是______(单选).
(2)锂电池工作时,将化学能转化为______ 。
(3)锂位于元素周期表中第______ 周期______ 族;磷酸亚铁锂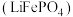 中
中 的化合价为
的化合价为______ .
(4)铁的原子结构示意图为 .由此可知,铁的原子序数为
.由此可知,铁的原子序数为______ ;x为______ ;铁元素是______ (双选).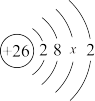 A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是______(单选).
(6)能与 反应,且可证明
反应,且可证明 具有氧化性的是______(双选).
具有氧化性的是______(双选).
(7)除去氯化亚铁溶液中的氯化铁,需加入______ ,发生的离子反应为______ ,要检验废液中是否还存在 ,实验方案是
,实验方案是____________ 。
(8) 可作载人潜水器供氧剂,下列关于
可作载人潜水器供氧剂,下列关于 说法正确的是______(单选)。
说法正确的是______(单选)。
钛因为具有神奇的性能越来越引起人们的关注.常温下钛不与非金属、强酸反应。目前大规模生产钛的方法是,第一步将金红石(含 )、炭粉混合,在高温条件下通入
)、炭粉混合,在高温条件下通入 制得
制得 :
: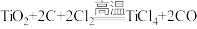 ①;第二步在氩气的气氛中,用过量的镁在加热条件下与
①;第二步在氩气的气氛中,用过量的镁在加热条件下与 反应制得金属钛:
反应制得金属钛: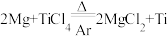 ②。
②。
(9)反应①的还原剂为______ ,反应消耗了标准状况下 氯气,则反应①转移的电子数为
氯气,则反应①转移的电子数为___ 。
(10)简述从反应②所得产物中获取金属钛的步骤:______________ 。
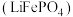 可作为锂电池的正极材料,请回答下列问题:
可作为锂电池的正极材料,请回答下列问题:(1)潜水器外壳使用的钛合金不可能具有的性质是______(单选).
| A.耐高压 | B.耐腐蚀 | C.硬度小 | D.密度小 |
(3)锂位于元素周期表中第
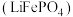 中
中 的化合价为
的化合价为(4)铁的原子结构示意图为
 .由此可知,铁的原子序数为
.由此可知,铁的原子序数为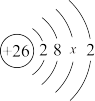 A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
A.主族元素 B.副族元素 C.短周期元素 D.长周期元素(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是______(单选).
A. | B. | C. | D. |
 反应,且可证明
反应,且可证明 具有氧化性的是______(双选).
具有氧化性的是______(双选).A. | B. | C. | D. |
 ,实验方案是
,实验方案是(8)
 可作载人潜水器供氧剂,下列关于
可作载人潜水器供氧剂,下列关于 说法正确的是______(单选)。
说法正确的是______(单选)。| A.只有离子键 | B.可在常温下由 与 与 反应制得 反应制得 |
C.与 发生化合反应 发生化合反应 | D.与 反应有 反应有 生成 生成 |
钛因为具有神奇的性能越来越引起人们的关注.常温下钛不与非金属、强酸反应。目前大规模生产钛的方法是,第一步将金红石(含
 )、炭粉混合,在高温条件下通入
)、炭粉混合,在高温条件下通入 制得
制得 :
: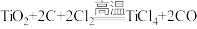 ①;第二步在氩气的气氛中,用过量的镁在加热条件下与
①;第二步在氩气的气氛中,用过量的镁在加热条件下与 反应制得金属钛:
反应制得金属钛: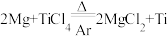 ②。
②。(9)反应①的还原剂为
 氯气,则反应①转移的电子数为
氯气,则反应①转移的电子数为(10)简述从反应②所得产物中获取金属钛的步骤:
您最近一年使用:0次
名校
解题方法
4 . 铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近一年使用:0次
5 . 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请回答下列问题
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是___________ ;写出镓的氯化物和氨水反应的化学方程式___________ 。铍、铝二者的单质、化合物均具有相似的化学性质,写出BeCl2溶液与Na2BeO2的水溶液混合的化学方程式___________ 。
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
(3)在稀 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为___________ (用化学式表示)。
(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为___________ 。
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
| A.青铜、不锈钢、硬铝都是合金 |
| B.铜表面易形成致密的氧化膜 |
| C.铜与O2反应生成黑色的CuO |
| D.CuSO4·5H2O是一种混合物,加热后变为白色固体 |
 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?
您最近一年使用:0次
名校
解题方法
6 . 某小组同学探究菠菜补铁的可行性。
【提出猜想】假设1:菠菜中铁元素以Fe2+形式存在;
假设2:______;
假设3:菠菜中铁元素以Fe2+和Fe3+形式存在。
(1)将假设2补充完整:_______ 。
【设计实验方案】
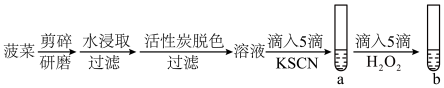
(2)加入KSCN的目的是_______ 。
(3)若观察到_______ ,则证明假设3成立。
(4)经实验,试管a、b中均无明显现象。为探查原因,查阅资料得知:菠菜中的铁元素以草酸亚铁(FeC2O4)的形式存在。FeC2O4难溶于水,高温下可分解产生FeO以及气体产物。
①经检验,气体产物中含有CO2,由此同学们推测气体中应含有CO,理由是______ 。
②实验证明气体产物为CO2和CO,n(CO2):n(CO)=______ 。
【实验反思】
(5)未检测到菠菜中的铁元素,原因可能是_______ 。
【修正实验方案】

(6)①试剂x为______ 。
②取适量滤液于试管中,加入试剂y,即可证明菠菜中含有+2价铁元素。该试剂y为_______ ,现象是______ 。
【可行性分析】
(7)成年人每天所需铁元素的质量为20mg,每100g菠菜中含铁元素约为2mg,铁吸收率约为2%。
①100g菠菜中含FeC2O4的物质的量为______ mol(列出计算式)。
②若要满足成年人对铁元素的需求量,则需要每天食用菠菜______ kg。
【提出猜想】假设1:菠菜中铁元素以Fe2+形式存在;
假设2:______;
假设3:菠菜中铁元素以Fe2+和Fe3+形式存在。
(1)将假设2补充完整:
【设计实验方案】

(2)加入KSCN的目的是
(3)若观察到
(4)经实验,试管a、b中均无明显现象。为探查原因,查阅资料得知:菠菜中的铁元素以草酸亚铁(FeC2O4)的形式存在。FeC2O4难溶于水,高温下可分解产生FeO以及气体产物。
①经检验,气体产物中含有CO2,由此同学们推测气体中应含有CO,理由是
②实验证明气体产物为CO2和CO,n(CO2):n(CO)=
【实验反思】
(5)未检测到菠菜中的铁元素,原因可能是
【修正实验方案】

(6)①试剂x为
②取适量滤液于试管中,加入试剂y,即可证明菠菜中含有+2价铁元素。该试剂y为
【可行性分析】
(7)成年人每天所需铁元素的质量为20mg,每100g菠菜中含铁元素约为2mg,铁吸收率约为2%。
①100g菠菜中含FeC2O4的物质的量为
②若要满足成年人对铁元素的需求量,则需要每天食用菠菜
您最近一年使用:0次
7 . 铁与空气接触时会形成氧化物,如一块低碳钢可以被三种氧化物膜所覆盖与金属接触的一侧是FeO,与空气接触的一侧是 ,而中间则是
,而中间则是 。
。
(1)中国古代“四大发明”之一最早的指南针“司南”,其具有磁性作用是因为主要含有上述物质中的___________ (填化学式)。
(2) 的一种用途是
的一种用途是___________ 。(填“用作油漆、涂料 ”或“磁电机”);
(3)FeO可作化妆品中的色素,它还能进行一系列转化: 。
。
① 时应加入的试剂是
时应加入的试剂是___________ (填“H2SO4”或“Na2SO4”)。
②“速力菲”(主要有效成分是 )是一种常见的补铁药物,欲验证该药物超过保质期后已变质,具体操作为:首先除去药物表面包装的糖衣,再将药物粉碎、加水溶解静置、取少许溶液于试管中,向其中加入
)是一种常见的补铁药物,欲验证该药物超过保质期后已变质,具体操作为:首先除去药物表面包装的糖衣,再将药物粉碎、加水溶解静置、取少许溶液于试管中,向其中加入___________ (填“KSCN”或“K2SO4”),若出现___________ (填“红色”或“浅绿色”)现象,则证明该药物已变质。
③在 中滴加NaOH溶液的实验现象是先产生白色絮状沉淀,然后迅速变成灰绿色,最终变成
中滴加NaOH溶液的实验现象是先产生白色絮状沉淀,然后迅速变成灰绿色,最终变成___________ (填“红褐色”或“黄色”),其中沉淀颜色发生变化的化学方程式为___________ 。
 ,而中间则是
,而中间则是 。
。(1)中国古代“四大发明”之一最早的指南针“司南”,其具有磁性作用是因为主要含有上述物质中的
(2)
 的一种用途是
的一种用途是(3)FeO可作化妆品中的色素,它还能进行一系列转化:
 。
。①
 时应加入的试剂是
时应加入的试剂是②“速力菲”(主要有效成分是
 )是一种常见的补铁药物,欲验证该药物超过保质期后已变质,具体操作为:首先除去药物表面包装的糖衣,再将药物粉碎、加水溶解静置、取少许溶液于试管中,向其中加入
)是一种常见的补铁药物,欲验证该药物超过保质期后已变质,具体操作为:首先除去药物表面包装的糖衣,再将药物粉碎、加水溶解静置、取少许溶液于试管中,向其中加入③在
 中滴加NaOH溶液的实验现象是先产生白色絮状沉淀,然后迅速变成灰绿色,最终变成
中滴加NaOH溶液的实验现象是先产生白色絮状沉淀,然后迅速变成灰绿色,最终变成
您最近一年使用:0次
解题方法
8 . 从物质类别和元素化合价两个角度研究物质的性质,是一种行之有效的方法。某研究小组对下列物质展开研究:
①用饱和FeCl3溶液制得的胶体 ②乙醇 ③Al2O3 ④Na2CO3·10H2O ⑤FeCl3溶液 ⑥CO2 ⑦液氯 ⑧烧碱溶液 ⑨熔融的K2SO4 ⑩NaHSO4溶液 ⑪Fe
请回答:
(1)某同学采用分类的方法进行研究。他将①⑤⑧⑩归为一类,其分类依据为_______ ;此外,他还认为可将_______ (填物质编号)归为电解质。
(2)可证明③是两性氧化物的实验证据为_______ (用离子方程式表示)。
(3)NaHSO4虽属于盐类物质,但其溶液呈酸性,依据为______ (用电离方程式表示)。向⑩中滴加Ba(OH)2溶液至不再产生沉淀,反应的离子方程式为_______ ,检验反应后所得溶液中是否含有 的实验方法为
的实验方法为________ 。
(4)某同学欲探究 的氧化性,向⑤中加入足量
的氧化性,向⑤中加入足量________ (填物质编号)后过滤,随即向所得的滤液中加入足量 溶液,可观察到的现象为
溶液,可观察到的现象为________ 。
①用饱和FeCl3溶液制得的胶体 ②乙醇 ③Al2O3 ④Na2CO3·10H2O ⑤FeCl3溶液 ⑥CO2 ⑦液氯 ⑧烧碱溶液 ⑨熔融的K2SO4 ⑩NaHSO4溶液 ⑪Fe
请回答:
(1)某同学采用分类的方法进行研究。他将①⑤⑧⑩归为一类,其分类依据为
(2)可证明③是两性氧化物的实验证据为
(3)NaHSO4虽属于盐类物质,但其溶液呈酸性,依据为
 的实验方法为
的实验方法为(4)某同学欲探究
 的氧化性,向⑤中加入足量
的氧化性,向⑤中加入足量 溶液,可观察到的现象为
溶液,可观察到的现象为
您最近一年使用:0次
解题方法
9 . 化学小组同学通过实验探究某补铁药品中含亚铁盐,实验过程如下:
(1)甲同学取少量溶液,先加入2滴 溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为
溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为__________ 。
(2)乙同学也取少量溶液,滴加 溶液,有沉淀生成;将其露置于空气中可观察到的现象是
溶液,有沉淀生成;将其露置于空气中可观察到的现象是__________ ;产生该现象原因是__________ (用化学方程式解释)。
(3)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是__________ 。
(1)甲同学取少量溶液,先加入2滴
 溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为
溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为(2)乙同学也取少量溶液,滴加
 溶液,有沉淀生成;将其露置于空气中可观察到的现象是
溶液,有沉淀生成;将其露置于空气中可观察到的现象是(3)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是
您最近一年使用:0次
名校
10 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为___________ 。(写出一条即可)

(2)乙组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:
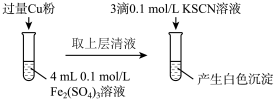
①Fe3+与Cu反应的离子方程式为___________ 。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2。
实验方案:
Cu2+与SCN-反应的离子方程式为 ___________ 。
(3)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称猜测该糖浆中含有Fe2+,设计方案进行验证。
①方案ⅰ预期现象与实际现象相同,并不能证明补贴口服液中一定含有Fe2+,猜想理由是:___________ 。
②方案ⅱ中实验现象是___________ ,证明补铁口服液中含有Fe2+。
(1)甲组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为

(2)乙组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2。
实验方案:
| 实验方案 | 现象 |
| 步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液 | 无明显现象 |
| 步骤2:取4mL 0.1 mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液 | 产生白色沉淀 |
(3)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称猜测该糖浆中含有Fe2+,设计方案进行验证。
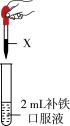 | 方案 | 试剂X |
| 方案ⅰ | 1mL 1mol/L酸性KMnO4溶液 | |
| 方案ⅱ | 依次加入5滴KSCN溶液、1mL新制氯水 |
②方案ⅱ中实验现象是
您最近一年使用:0次



