名校
解题方法
1 . 某小组同学探究菠菜补铁的可行性。
【提出猜想】假设1:菠菜中铁元素以Fe2+形式存在;
假设2:______;
假设3:菠菜中铁元素以Fe2+和Fe3+形式存在。
(1)将假设2补充完整:_______ 。
【设计实验方案】
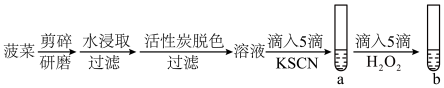
(2)加入KSCN的目的是_______ 。
(3)若观察到_______ ,则证明假设3成立。
(4)经实验,试管a、b中均无明显现象。为探查原因,查阅资料得知:菠菜中的铁元素以草酸亚铁(FeC2O4)的形式存在。FeC2O4难溶于水,高温下可分解产生FeO以及气体产物。
①经检验,气体产物中含有CO2,由此同学们推测气体中应含有CO,理由是______ 。
②实验证明气体产物为CO2和CO,n(CO2):n(CO)=______ 。
【实验反思】
(5)未检测到菠菜中的铁元素,原因可能是_______ 。
【修正实验方案】

(6)①试剂x为______ 。
②取适量滤液于试管中,加入试剂y,即可证明菠菜中含有+2价铁元素。该试剂y为_______ ,现象是______ 。
【可行性分析】
(7)成年人每天所需铁元素的质量为20mg,每100g菠菜中含铁元素约为2mg,铁吸收率约为2%。
①100g菠菜中含FeC2O4的物质的量为______ mol(列出计算式)。
②若要满足成年人对铁元素的需求量,则需要每天食用菠菜______ kg。
【提出猜想】假设1:菠菜中铁元素以Fe2+形式存在;
假设2:______;
假设3:菠菜中铁元素以Fe2+和Fe3+形式存在。
(1)将假设2补充完整:
【设计实验方案】

(2)加入KSCN的目的是
(3)若观察到
(4)经实验,试管a、b中均无明显现象。为探查原因,查阅资料得知:菠菜中的铁元素以草酸亚铁(FeC2O4)的形式存在。FeC2O4难溶于水,高温下可分解产生FeO以及气体产物。
①经检验,气体产物中含有CO2,由此同学们推测气体中应含有CO,理由是
②实验证明气体产物为CO2和CO,n(CO2):n(CO)=
【实验反思】
(5)未检测到菠菜中的铁元素,原因可能是
【修正实验方案】

(6)①试剂x为
②取适量滤液于试管中,加入试剂y,即可证明菠菜中含有+2价铁元素。该试剂y为
【可行性分析】
(7)成年人每天所需铁元素的质量为20mg,每100g菠菜中含铁元素约为2mg,铁吸收率约为2%。
①100g菠菜中含FeC2O4的物质的量为
②若要满足成年人对铁元素的需求量,则需要每天食用菠菜
您最近一年使用:0次
解题方法
2 . 化学小组同学通过实验探究某补铁药品中含亚铁盐,实验过程如下:
(1)甲同学取少量溶液,先加入2滴 溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为
溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为__________ 。
(2)乙同学也取少量溶液,滴加 溶液,有沉淀生成;将其露置于空气中可观察到的现象是
溶液,有沉淀生成;将其露置于空气中可观察到的现象是__________ ;产生该现象原因是__________ (用化学方程式解释)。
(3)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是__________ 。
(1)甲同学取少量溶液,先加入2滴
 溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为
溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为(2)乙同学也取少量溶液,滴加
 溶液,有沉淀生成;将其露置于空气中可观察到的现象是
溶液,有沉淀生成;将其露置于空气中可观察到的现象是(3)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是
您最近一年使用:0次
3 . Ⅰ.钠、铝、铁是三种重要的金属,它们的单质及其化合物在生活生产中有重要的作用。请回答下列问题:
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:_______ ,该反应中氧化剂和还原剂的物质的量之比为______ 。
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是: 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ (填化学式),该试剂与金属铝反应的离子方程式为_______ 。
(3)另一同学推测铝热反应得到的熔融物中还含有 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是_______ (填化学式)。该同学的实验方案是否合理?______ (填“合理”或“不合理”)。理由:_______ (用离子方程式说明)。
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是:
 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。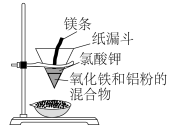
| 物质 | Al |  | Fe |  |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有
 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是
您最近一年使用:0次
2024-01-10更新
|
179次组卷
|
3卷引用:辽宁省部分高中2023-2024学年高一上学期期末考试高化学试题
辽宁省部分高中2023-2024学年高一上学期期末考试高化学试题辽宁省辽南协作体2023-2024学年高一上学期期末考试化学试题(已下线)专题06 化学与可持续发展-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
名校
解题方法
4 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至液体是透明的_____ 色,停止加热,即制得Fe(OH)3胶体。用激光笔照射烧杯中的液体,可以看到_____ 。
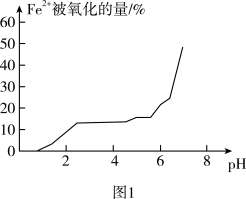
(2)甲组同学通过研究pH对FeSO4稳定性的影响,得到如图1所示结果,增强Fe2+稳定性的措施为_____ 。
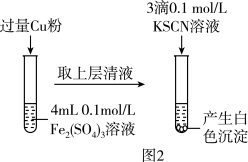
(3)乙组同学为探究Fe2(SO4)3与Cu的反应,进行如图2所示实验:
①Fe3+与Cu反应的离子方程式为_____ 。
②为了探究白色沉淀产生的原因,向学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2+4I-=2CuI↓+I2
填写实验方案:
Cu 与SCN-反应的离子方程式为
与SCN-反应的离子方程式为_____ 。
(4)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。
①方案冲预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,猜想理由是_____ 。
②方案ii中现象是_____ ,则证明口服液中含Fe2+。
(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至液体是透明的
(2)甲组同学通过研究pH对FeSO4稳定性的影响,得到如图1所示结果,增强Fe2+稳定性的措施为

(3)乙组同学为探究Fe2(SO4)3与Cu的反应,进行如图2所示实验:

①Fe3+与Cu反应的离子方程式为
②为了探究白色沉淀产生的原因,向学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2+4I-=2CuI↓+I2
填写实验方案:
| 实验方案 | 实验现象 |
| 少骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mo/LKSCN溶液 | 无明显现象 |
| 步骤2:取4mL | 产生白色沉淀 |
 与SCN-反应的离子方程式为
与SCN-反应的离子方程式为(4)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。
 | 方案 | 试剂X |
| 方案i | 1mL1mol/L酸性KMnO4溶液 | |
| 方案ii | 依次加入5滴KSCN溶液。1mL氨水 |
②方案ii中现象是
您最近一年使用:0次
2023-03-26更新
|
348次组卷
|
2卷引用:河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题
解题方法
5 . 阅读下列材料后,回答相应问题。
铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化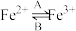 ,A反应中Fe2+作
,A反应中Fe2+作________ 剂,B反应中Fe3+作________ 剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有________ 性。
(2)新配制的FeCl2溶液应加入________ 以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的_____ 。
(3)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。反应的离子方程式为______ 。
(4)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程可用两个离子方程式表示为_______ , ________ ;处理过程中需定期添加的原料是______ 。
(5)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:
取少许未知试液于试管中 溶液呈红色(证明含有FeCl2),你认为此方案
溶液呈红色(证明含有FeCl2),你认为此方案______ (填“合理”或“不合理”),若不合理,如何改进:______ 。
铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化
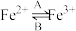 ,A反应中Fe2+作
,A反应中Fe2+作(2)新配制的FeCl2溶液应加入
(3)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。反应的离子方程式为
(4)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程可用两个离子方程式表示为
(5)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:
取少许未知试液于试管中
 溶液呈红色(证明含有FeCl2),你认为此方案
溶液呈红色(证明含有FeCl2),你认为此方案
您最近一年使用:0次
名校
解题方法
6 . 某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。
I.探究FeCl2溶液的性质。
(1)从物质类别角度判断FeCl2属于___________ ,因此可以与某些碱反应。
(2)预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现___________ 性。
(3)预测FeCl2具有还原性,预测依据是___________ ,因此可以与酸性KMnO4溶液反应。
(4)进行如下实验操作:
①i中的现象是___________ ,用化学方程式表示产生该现象的原因:___________ 、___________ 。
②ii中反应的离子方程式是___________ 。
③iii中的现象是___________ 。
(5)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②___________ , 为证实该反应中Fe2+确实被氧化,需要在反应后的溶液中加入试剂___________ ,观察到现象___________ 。
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(6)iv中反应的离子方程式是___________ 。
(7)vi 中滴加氯水过程中,氯水反应的离子方程式是___________ 。
III.小组同学探究vi中褪色原因,提出两种假设: a.铁离子被转化,b. SCN被转化。
(8)分别向褪色后的溶液中滴加0.1 mol/L FeCl3溶液和KSCN溶液各1滴,观察到___________ 现象,得出结论:假设b成立。
(9)进一步预测SCN-可能被转化为SO ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象___________ 。
I.探究FeCl2溶液的性质。
(1)从物质类别角度判断FeCl2属于
(2)预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现
(3)预测FeCl2具有还原性,预测依据是
(4)进行如下实验操作:
 | 序号 | 操作 |
| i | 滴加NaOH溶液 | |
| ii | 加入少量锌粉 | |
| iii | 滴加酸性KMnO4溶液 |
②ii中反应的离子方程式是
③iii中的现象是
(5)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
| 操作 |  |  | 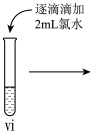 |
| 现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色, 而后红色褪去 |
(7)vi 中滴加氯水过程中,氯水反应的离子方程式是
III.小组同学探究vi中褪色原因,提出两种假设: a.铁离子被转化,b. SCN被转化。
(8)分别向褪色后的溶液中滴加0.1 mol/L FeCl3溶液和KSCN溶液各1滴,观察到
(9)进一步预测SCN-可能被转化为SO
 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象
您最近一年使用:0次
2022-01-12更新
|
721次组卷
|
5卷引用:北京市昌平区2021-2022学年高一上学期期末考试化学试题
北京市昌平区2021-2022学年高一上学期期末考试化学试题 (已下线)3.1.2 铁盐和亚铁盐-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)广东省广州市第二中学2022-2023学年高一上学期12月月考化学试题9.2.1反应的合理选择(课后)-2019苏教版必修2课前课中课后河南省郑州市第七高级中学2023-2024学年高一上学期12月考试化学试题
名校
7 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是___________(填字母代号)。
(2)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是___________ nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:首先取少量待测溶液﹐滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是___________ ,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,___________ (填实验操作,下同)、___________ 、干燥,称量沉淀质量为43.05g。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是___________ (填字母代号)。
A.向试管中加入试液,滴入KSCN溶液,若显红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
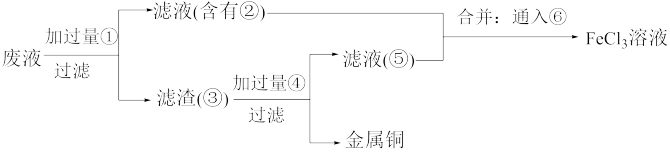
A.请写出上述实验中加入或生成的有关物质的化学式:①___________ ;②___________ ;③___________ ;④___________ 。
B.请写出通入⑥的化学方程式:___________ 。
(1)所含铁元素既有氧化性又有还原性的物质是___________(填字母代号)。
| A.Fe | B.FeCl2 | C.FeSO4 | D.Fe2O3 |
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(4)若要验证该溶液中含有Fe2+,正确的实验方法是
A.向试管中加入试液,滴入KSCN溶液,若显红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液,设计实验方案如下:

A.请写出上述实验中加入或生成的有关物质的化学式:①
B.请写出通入⑥的化学方程式:
您最近一年使用:0次
名校
8 . 铁及其重要化合物之间的部分转化关系如图所示。

(1)下列金属矿物中用于冶炼金属铁的是_______ (填序号);
a.金红石(TiO2) b.赤铁矿(Fe2O3) c.辉铜矿(Cu2S)
(2)实现Fe转化为Fe2+可选用足量的_______ (填序号);
a.稀盐酸 b.氢氧化钠溶液 c.稀硝酸
(3)在点燃的条件下,Fe与足量Cl2剧烈反应后,将产物溶于水,再滴加KSCN溶液,则溶液变为_______ 色,证明产物为FeCl3,写出氯气和铁反应的化学方程式为_______ ;
(4)某同学将FeSO4溶液与NaOH溶液混合,未观察到白色沉淀,分析原因是生成的Fe(OH)2易被空气中的O2氧化,请你设计一个防止Fe(OH)2被O2氧化的实验方案_______

(1)下列金属矿物中用于冶炼金属铁的是
a.金红石(TiO2) b.赤铁矿(Fe2O3) c.辉铜矿(Cu2S)
(2)实现Fe转化为Fe2+可选用足量的
a.稀盐酸 b.氢氧化钠溶液 c.稀硝酸
(3)在点燃的条件下,Fe与足量Cl2剧烈反应后,将产物溶于水,再滴加KSCN溶液,则溶液变为
(4)某同学将FeSO4溶液与NaOH溶液混合,未观察到白色沉淀,分析原因是生成的Fe(OH)2易被空气中的O2氧化,请你设计一个防止Fe(OH)2被O2氧化的实验方案
您最近一年使用:0次
2021-04-06更新
|
521次组卷
|
3卷引用:海南省儋州市第二中学2020-2021学年高一下学期3月月考化学(合格考)试题
解题方法
9 . (1)用 配制
配制 溶液时,为防止
溶液时,为防止 被氧化,需加入稀硫酸和稍过量的
被氧化,需加入稀硫酸和稍过量的____ 。
(2)在 溶液中滴入稀硫酸,再滴入几滴
溶液中滴入稀硫酸,再滴入几滴 溶液,溶液立即变黄。上述反应的离子方程式为
溶液,溶液立即变黄。上述反应的离子方程式为_____ 。
(3)为检验(2)中的氧化产物,甲同学取少许反应后的溶液,加入______ 溶液,溶液变血红色,证明氧化产物为 ;乙同学取少许反应后的溶液,加入
;乙同学取少许反应后的溶液,加入____ 溶液,溶液变蓝,证明氧化产物为 ,该反应的离子方程式为
,该反应的离子方程式为_____________ 。
(4)为证明(2)中反应后的溶液中仍存在 ,可向其中滴加
,可向其中滴加____ 溶液。
 配制
配制 溶液时,为防止
溶液时,为防止 被氧化,需加入稀硫酸和稍过量的
被氧化,需加入稀硫酸和稍过量的(2)在
 溶液中滴入稀硫酸,再滴入几滴
溶液中滴入稀硫酸,再滴入几滴 溶液,溶液立即变黄。上述反应的离子方程式为
溶液,溶液立即变黄。上述反应的离子方程式为(3)为检验(2)中的氧化产物,甲同学取少许反应后的溶液,加入
 ;乙同学取少许反应后的溶液,加入
;乙同学取少许反应后的溶液,加入 ,该反应的离子方程式为
,该反应的离子方程式为(4)为证明(2)中反应后的溶液中仍存在
 ,可向其中滴加
,可向其中滴加
您最近一年使用:0次
解题方法
10 . 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___ ,证明Fe3+存在的现象是____ ,配制含Fe2+的溶液时,常常向溶液中加入少量___ ,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___ 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
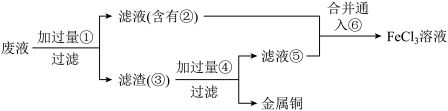
A.请写出上述实验中加入或生成的有关物质的化学式。
①___ ,②___ ,③___ ,④____ ,⑤____ ,⑥_____ 。
B.请写出相关反应的化学方程式。_______ 。
(1)检验溶液中Fe3+存在的常用试剂是
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

A.请写出上述实验中加入或生成的有关物质的化学式。
①
B.请写出相关反应的化学方程式。
您最近一年使用:0次
2020-01-07更新
|
268次组卷
|
4卷引用:云南省临沧市耿马县民族中学2019-2020学年高一上学期12月月考化学试题
云南省临沧市耿马县民族中学2019-2020学年高一上学期12月月考化学试题贵州省黎平第二中学2019-2020学年高一上学期期末考试化学试题广西壮族自治区崇左市天等县民族高中2019-2020学年高一上学期期末考试化学试题(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)



