1 . 铁是人体必需的微量元素之一,菠菜、黑木耳等食品中富含铁元素,其中菠菜中的铁元素至要以草酸亚铁 的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。
的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。
(1)草酸亚铁溶于稀硫酸的化学方程式是_______ 。
(2)菠菜的预处理

上述预处理流程中需要用到的仪器有烧杯、玻璃棒、酒精灯、_______ (从下图中选择,写出名称)。
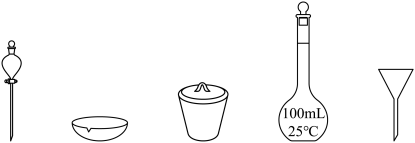
(3)检验待测液中是否含有 、
、
(4)利用 标准溶液测定菠菜中铁元素的含量
标准溶液测定菠菜中铁元素的含量
步骤I:取10.00mL待测液于锥形瓶中,滴加 溶液至溶液显紫色。
溶液至溶液显紫色。
步骤II:向步骤I得到的混合液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤III:向步骤II所得待测液中加入适量稀 溶液,用
溶液,用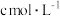 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液VmL。
溶液VmL。
①步骤I滴加 溶液的目的是
溶液的目的是_______ 。
②步骤III滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_______ 。
 的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。
的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。(1)草酸亚铁溶于稀硫酸的化学方程式是
(2)菠菜的预处理

上述预处理流程中需要用到的仪器有烧杯、玻璃棒、酒精灯、

(3)检验待测液中是否含有
 、
、
| 检验试剂 | 现象 | 结论 |
| ① | 溶液变为红色 | 滤液中含有 |
| ② | ③ | 滤液中含有 |
 标准溶液测定菠菜中铁元素的含量
标准溶液测定菠菜中铁元素的含量步骤I:取10.00mL待测液于锥形瓶中,滴加
 溶液至溶液显紫色。
溶液至溶液显紫色。步骤II:向步骤I得到的混合液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤III:向步骤II所得待测液中加入适量稀
 溶液,用
溶液,用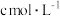 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液VmL。
溶液VmL。①步骤I滴加
 溶液的目的是
溶液的目的是②步骤III滴加
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为
您最近一年使用:0次
2 . 某废旧合金材料中主要含Fe、Cu、Al及其氧化物,为节约和充分利用资源,通过如下工艺流程回收Cu、Al,并制取绿矾等。
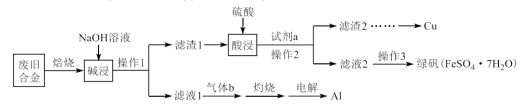
回答下列问题:
(1)写出“碱浸”时发生反应的化学方程式_______ 。
(2)“滤液1”中通入过量“气体b”产生沉淀,写出其反应的离子方程式_______ 。
(3)操作3包括加入少量稀硫酸、_______ 、过滤、洗涤、干燥。
(4)绿矾可用作净水剂,在医学上可用作补血剂,绿矾在空气中易被氧化为硫酸铁等。
①为检验绿矾中是否含有 ,可选择的最佳试剂组合是
,可选择的最佳试剂组合是_______ (填标号)。
a.稀盐酸、 溶液 b.稀硝酸、KSCN溶液
溶液 b.稀硝酸、KSCN溶液
c.稀盐酸、KSCN溶液 d.稀硫酸、NaOH溶液
②现取一定量部分被氧化的绿矾,溶于稀盐酸后,加入足量的 溶液,过滤得9.32g沉淀;再通入标准状况下
溶液,过滤得9.32g沉淀;再通入标准状况下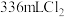 ,恰好将滤液中的
,恰好将滤液中的 完全氧化。则该绿矾中
完全氧化。则该绿矾中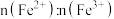 的比值是多少
的比值是多少______ (不要求计算过程)?

回答下列问题:
(1)写出“碱浸”时发生反应的化学方程式
(2)“滤液1”中通入过量“气体b”产生沉淀,写出其反应的离子方程式
(3)操作3包括加入少量稀硫酸、
(4)绿矾可用作净水剂,在医学上可用作补血剂,绿矾在空气中易被氧化为硫酸铁等。
①为检验绿矾中是否含有
 ,可选择的最佳试剂组合是
,可选择的最佳试剂组合是a.稀盐酸、
 溶液 b.稀硝酸、KSCN溶液
溶液 b.稀硝酸、KSCN溶液c.稀盐酸、KSCN溶液 d.稀硫酸、NaOH溶液
②现取一定量部分被氧化的绿矾,溶于稀盐酸后,加入足量的
 溶液,过滤得9.32g沉淀;再通入标准状况下
溶液,过滤得9.32g沉淀;再通入标准状况下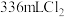 ,恰好将滤液中的
,恰好将滤液中的 完全氧化。则该绿矾中
完全氧化。则该绿矾中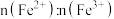 的比值是多少
的比值是多少
您最近一年使用:0次
名校
解题方法
3 . 某种催化剂为铁的氧化物。化学兴趣小组对该催化剂中铁元素的价态进行了探究。请回答下列实验方案中的有关问题:
(一)实验仪器与试剂
仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
试剂:3mol·L-1H2SO4、6mol·L-1HNO3、0.01mol·L-1KMnO4、NaOH稀溶液、20%KSCN溶液、蒸馏水。
(二)实验原理
Fe2+能使酸性KMnO4溶液紫色褪去;Fe3+溶液中滴加KSCN溶液变红色。
(1)一位同学将少许样品溶于稀硝酸中,取少许溶液滴加KSCN溶液后出现红色。由此得出为铁元素为+3价的结论。该结论是否合理并说明理由___ 。
(三)实验设计
(2)提出合理假设。
假设1:催化剂中铁元素全部为+3价;
假设2:催化剂中铁元素全部为+2价;
假设3:___ 。
(3)设计实验证明假设。请完成下表中的实验操作步骤,预期现象与结论。
(一)实验仪器与试剂
仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
试剂:3mol·L-1H2SO4、6mol·L-1HNO3、0.01mol·L-1KMnO4、NaOH稀溶液、20%KSCN溶液、蒸馏水。
(二)实验原理
Fe2+能使酸性KMnO4溶液紫色褪去;Fe3+溶液中滴加KSCN溶液变红色。
(1)一位同学将少许样品溶于稀硝酸中,取少许溶液滴加KSCN溶液后出现红色。由此得出为铁元素为+3价的结论。该结论是否合理并说明理由
(三)实验设计
(2)提出合理假设。
假设1:催化剂中铁元素全部为+3价;
假设2:催化剂中铁元素全部为+2价;
假设3:
(3)设计实验证明假设。请完成下表中的实验操作步骤,预期现象与结论。
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用滴管取一定量3mol·L-1H2SO4于试管中, | 无明显现象 |
| 步骤2:用药匙取少量样品于试管中,用滴管加入除氧的3mol·L-1H2SO4,并加热,充分反应后得A溶液。 | 固体溶解,溶液颜色发生变化 |
| 步骤3:取少许A溶液于试管中 | 若溶液不呈红色,则假设2成立;若 |
| 步骤4:另取少许A溶液于试管中, | 结合③,若 |
您最近一年使用:0次
2021-08-21更新
|
200次组卷
|
2卷引用:2014年全国高中学生化学素质和实验能力竞赛决赛试题
名校
解题方法
4 . 电子工业中,常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。化学实验小组从腐蚀废液(含FeCl3、FeCl2、CuCl2)中回收铜并重新获得FeCl3晶体的流程如图:
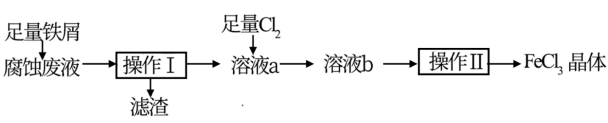
回答下列问题:
(1)检验腐蚀废液中含有Fe3+常用试剂是___ 。
(2)滤渣的成分是___ (填化学式)。从滤渣中获得铜单质,可选用的试剂是___ (填标号)。
A.稀盐酸 B.浓硫酸 C.稀硝酸 D.氯化铜溶液
(3)向溶液a中通入Cl2发生反应的离子方程式为___ 。有同学建议,使用H2O2代替Cl2以减少污染,则反应中氧化剂与还原剂的物质的量之比为___ 。
(4)甲同学用酸性KMnO4溶液检测溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是__ (用离子方程式表示)。

回答下列问题:
(1)检验腐蚀废液中含有Fe3+常用试剂是
(2)滤渣的成分是
A.稀盐酸 B.浓硫酸 C.稀硝酸 D.氯化铜溶液
(3)向溶液a中通入Cl2发生反应的离子方程式为
(4)甲同学用酸性KMnO4溶液检测溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是
您最近一年使用:0次
2021-01-28更新
|
405次组卷
|
2卷引用:山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题
5 . 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴试剂1是__________ 。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是______________________________________ 。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)_______________
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为_______ 。

⑴试剂1是
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的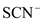 被过量的氯水氧化 被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为
您最近一年使用:0次
2011高二·安徽·竞赛
6 . 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)向滤液Y中通入少量CO2时生成的沉淀只有F,发生反应的离子方程式为___________ ;判断OH-、SiO32-、AlO2-结合H+能力由强到弱的顺序为___________ ;
(2)欲检验滤液D中是否含有Fe3+,请写出检验该离子的实验操作___________ ;
(3)流程乙加入烧碱后生成SiO32-的离子方程式为___________ ;
(4)滤液E、K中相同的溶质为_______ (填化学式),将该物质的溶液加入到偏铝酸钠溶液中生成白色沉淀,写出该反应的离子方程式___________ 。

请回答下列问题:
(1)向滤液Y中通入少量CO2时生成的沉淀只有F,发生反应的离子方程式为
(2)欲检验滤液D中是否含有Fe3+,请写出检验该离子的实验操作
(3)流程乙加入烧碱后生成SiO32-的离子方程式为
(4)滤液E、K中相同的溶质为
您最近一年使用:0次



