解题方法
1 .  是血红蛋白的重要组成成分,人体如果缺铁元素可能出现缺铁性贫血。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含质量分数为
是血红蛋白的重要组成成分,人体如果缺铁元素可能出现缺铁性贫血。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含质量分数为 ,是薄衣片,与维生素C同服可增加本品吸收。某同学设计实验对其中含铁元素的物质进行了验证,请完成该实验。
,是薄衣片,与维生素C同服可增加本品吸收。某同学设计实验对其中含铁元素的物质进行了验证,请完成该实验。
(1)向去掉糖衣,研磨好的药品中加稀盐酸,过滤,得到浅绿色溶液,说明药品中有_______________ (填离子符号)存在。
(2)向上述溶液中滴入几滴KSCN溶液,溶液显浅红色,说明溶液中有少量 存在。该离子存在的原因可能是
存在。该离子存在的原因可能是_________________ (填字母)。
a.药品中的铁元素以 形式存在
形式存在
b.在制药过程中生成少量
c.本实验过程中有少量 被氧化为
被氧化为
(3)将(2)中所得溶液分成2份,分别装在A、B两支试管中。向A试管的溶液中慢慢滴入适量氯水,溶液的红色变深。溶液红色变深的原因是___________________________________________ (用离子方程式表示)。
(4)向B试管的溶液中加入维生素C,片刻后溶液红色褪去,说明维生素C有___________________ 性。
 是血红蛋白的重要组成成分,人体如果缺铁元素可能出现缺铁性贫血。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含质量分数为
是血红蛋白的重要组成成分,人体如果缺铁元素可能出现缺铁性贫血。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含质量分数为 ,是薄衣片,与维生素C同服可增加本品吸收。某同学设计实验对其中含铁元素的物质进行了验证,请完成该实验。
,是薄衣片,与维生素C同服可增加本品吸收。某同学设计实验对其中含铁元素的物质进行了验证,请完成该实验。(1)向去掉糖衣,研磨好的药品中加稀盐酸,过滤,得到浅绿色溶液,说明药品中有
(2)向上述溶液中滴入几滴KSCN溶液,溶液显浅红色,说明溶液中有少量
 存在。该离子存在的原因可能是
存在。该离子存在的原因可能是a.药品中的铁元素以
 形式存在
形式存在b.在制药过程中生成少量

c.本实验过程中有少量
 被氧化为
被氧化为
(3)将(2)中所得溶液分成2份,分别装在A、B两支试管中。向A试管的溶液中慢慢滴入适量氯水,溶液的红色变深。溶液红色变深的原因是
(4)向B试管的溶液中加入维生素C,片刻后溶液红色褪去,说明维生素C有
您最近一年使用:0次
2020-10-02更新
|
503次组卷
|
2卷引用:人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物
名校
2 . Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______ .
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是______ .
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______ .简述你的理由______ .
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设______ 成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______ .
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
您最近一年使用:0次
2020-06-06更新
|
243次组卷
|
2卷引用:甘肃省西北师范大学附属中学2019-2020学年高一上学期期末考试化学试题
3 . 某同学以一种工业废渣(主要成分为MgCO3和少量C、Al2O3、FeSO4等)为原料制备MgCO3·3H2O,其设计的实验流程如下:
(1)质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为__________ 。
(2)滤渣的化学式为________ ;操作X的名称为__________ ,该操作需要的玻璃仪器是___________ 。
(3)已知:在下列实验中,当溶液中pH=8.5时,Mg(OH)2开始沉淀;pH=5.0时,Al(OH)3沉淀完全。请补充完整由操作X得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,________ ,过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O。

(1)质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为
(2)滤渣的化学式为
(3)已知:在下列实验中,当溶液中pH=8.5时,Mg(OH)2开始沉淀;pH=5.0时,Al(OH)3沉淀完全。请补充完整由操作X得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,
您最近一年使用:0次
名校
解题方法
4 . (1)合成氨工业生产中所用的αFe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、Fe2O3的物质的量之比为____ 。
②当催化剂中+2价Fe与+3价Fe的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物的混合物中铁原子的质量分数为____ (用小数表示,保留2位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
①用FeO稀盐酸、氯气制取FeCl3溶液的离子方程式为____ 、____ 。检验溶液中Fe3+的试剂是____ 。
②写出FeCl3溶液与金属铜发生反应的化学方程式:____ ,当转移电子数为6.02×1024时,被氧化的物质的质量为____ 。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、Fe2O3的物质的量之比为
②当催化剂中+2价Fe与+3价Fe的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物的混合物中铁原子的质量分数为
(2)电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
①用FeO稀盐酸、氯气制取FeCl3溶液的离子方程式为
②写出FeCl3溶液与金属铜发生反应的化学方程式:
您最近一年使用:0次
名校
5 . (1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4﹕5,其中FeO、Fe2O3的物质的量之比为__________ 。
②当催化剂中+2价铁与+3价铁的物质的量之比为1﹕2时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为_______________ 。 (用小数表示,保留2位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式为________________________ 、______________________________ 、______________________________ 。检验溶液中Fe3+存在的试剂是_______________ 。
②写出FeCl3溶液与金属铜发生反应的化学方程式_____________________________ ,当转移电子数为6.02×1024时,被氧化的物质的质量为_______________ 。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4﹕5,其中FeO、Fe2O3的物质的量之比为
②当催化剂中+2价铁与+3价铁的物质的量之比为1﹕2时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式为
②写出FeCl3溶液与金属铜发生反应的化学方程式
您最近一年使用:0次
解题方法
6 . 填空题
(1)“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO.
①Ca元素原子结构示意图________ ,Ca(OH)2碱性比Mg(OH)2______ (填“强”或“弱”).
②配平用“金属钙线”脱氧脱磷的方程式:___ P +____ FeO +____ CaO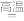
____ Ca3(PO4)2 +____ Fe
③将“金属钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n,该颜色变化过程的化学方程式为:_____________________ ,实验室检测Mn+最常用的试剂是___________ (填化学式)
④取3.2 g“金属钙线”试样,与水充分反应,生成448 mL H2(标准状况),在所得溶液中通入适量的CO2,最多能得到CaCO3________ g,“金属钙线”试样中金属M的质量分数为______ .
(2)氢化钙(CaH2)固体登山运动员常用的能源提供剂
①写出CaH2与水反应的化学方程式__________________ ,该反应的氧化产物是___ .
②请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象_____ .
③登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_______________________ .
(1)“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO.
①Ca元素原子结构示意图
②配平用“金属钙线”脱氧脱磷的方程式:
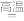
③将“金属钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n,该颜色变化过程的化学方程式为:
④取3.2 g“金属钙线”试样,与水充分反应,生成448 mL H2(标准状况),在所得溶液中通入适量的CO2,最多能得到CaCO3
(2)氢化钙(CaH2)固体登山运动员常用的能源提供剂
①写出CaH2与水反应的化学方程式
②请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象
③登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是
您最近一年使用:0次
20-21高一上·全国·课时练习
名校
解题方法
7 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对某绿矾样品进行了如下探究,请回答下列有关问题:
(1)在试管中加入少量该绿矾样品,加水溶解,分别滴加稀硫酸和KSCN溶液,溶液颜色无明显变化,由此得出的结论是__ 。若向试管中继续通入空气,观察到溶液逐渐变红,说明溶液中的Fe2+转化为___ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。
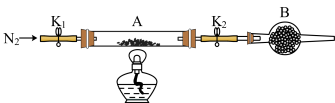
①仪器B的名称是__ ;B中可加入下列试剂中的__ (填标号)。
a.Al2O3 b.Ca(OH)2 c.CuSO4 d.NaCl
②打开K1和K2,缓缓通入N2,点燃酒精灯,加热,接下来的实验操作步骤正确排序是__ (填标号)。
a.熄灭酒精灯 b.关闭K1和K2
c.称量A d.冷却到室温
(1)在试管中加入少量该绿矾样品,加水溶解,分别滴加稀硫酸和KSCN溶液,溶液颜色无明显变化,由此得出的结论是
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①仪器B的名称是
a.Al2O3 b.Ca(OH)2 c.CuSO4 d.NaCl
②打开K1和K2,缓缓通入N2,点燃酒精灯,加热,接下来的实验操作步骤正确排序是
a.熄灭酒精灯 b.关闭K1和K2
c.称量A d.冷却到室温
您最近一年使用:0次
8 . 绿矾是含有一定量结晶水的硫酸亚铁(易被氧气氧化),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和
和 )(设为装置A)称重,记为
)(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按如图所示连接好装置进行实验。
。按如图所示连接好装置进行实验。
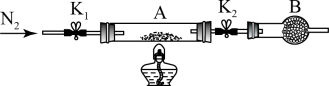
①仪器B的名称是____________ 。
②将下列实验操作步骤正确排序____ (填标号);重复上述操作步骤,直至装置A恒重,记为 。
。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭 和
和 d.打开
d.打开 和
和 ,缓缓通入
,缓缓通入 e.称量装置A f.冷却到室温
e.称量装置A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目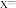
_________ (列式表示)。若实验时按a、d次序操作,则使x___________ “偏大”“偏小”或“无影响”)。
(2)为探究硫酸亚铁的分解产物,将(1)中已恒重的装置A接入如图所示的装置中,打开 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
,加热。实验后反应管中残留固体为红色粉末。

C、D中的溶液依次为________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______ 。
a.品红 b.NaOH c. d.
d.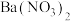 e.浓
e.浓
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关
 和
和 )(设为装置A)称重,记为
)(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按如图所示连接好装置进行实验。
。按如图所示连接好装置进行实验。
①仪器B的名称是
②将下列实验操作步骤正确排序
 。
。a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭
 和
和 d.打开
d.打开 和
和 ,缓缓通入
,缓缓通入 e.称量装置A f.冷却到室温
e.称量装置A f.冷却到室温③根据实验记录,计算绿矾化学式中结晶水数目
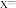
(2)为探究硫酸亚铁的分解产物,将(1)中已恒重的装置A接入如图所示的装置中,打开
 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
,加热。实验后反应管中残留固体为红色粉末。
C、D中的溶液依次为
a.品红 b.NaOH c.
 d.
d.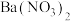 e.浓
e.浓
您最近一年使用:0次
9 . 硫酸亚铁晶体(FeSO4•7H2O)在医药上做补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如图所示:

请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后,溶液变为红色,则该滤液中含有___ (填离子符号),证明该补血剂__ (填“已经”或“没有”)变质。
(2)步骤②中反应的离子方程式:___ 。
(3)步骤③中反应的离子方程式:___ 。
(4)步骤④中一系列的操作步骤;过滤、__ 、灼烧、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为__ g。(用含a的代数式表示)

请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后,溶液变为红色,则该滤液中含有
(2)步骤②中反应的离子方程式:
(3)步骤③中反应的离子方程式:
(4)步骤④中一系列的操作步骤;过滤、
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
您最近一年使用:0次
名校
10 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加___ ,该过程的现象为:___
(2)步骤②加入过量H2O2的目的:____ 。
(3)步骤②③中反应的离子方程式:②_____ 、③____ 。
(4)步骤④中一系列处理的操作步骤:过滤、___ 、灼烧、____ 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量___ g。

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加
(2)步骤②加入过量H2O2的目的:
(3)步骤②③中反应的离子方程式:②
(4)步骤④中一系列处理的操作步骤:过滤、
(5)若实验无损耗,则每片补血剂含铁元素的质量
您最近一年使用:0次



