1 . 回答下列问题:
(1)向AlCl3溶液中持续 滴加NaOH溶液至过量 ,现象为____ 。写出产生上述现象所发生反应的化学方程式:____ ,____ 。
(2)白色絮状沉淀Fe(OH)2在空气中会迅速的变成灰绿色,最后变成红褐色,原因是发生了化学反应,请写出该反应的化学方程式:____ 。
(3)检验溶液中是否含有Fe3+的方法很多。
方法一:向某溶液中加入KSCN溶液,其现象是____ ,说明溶液中含有Fe3+。
方法二:向某溶液中加入NaOH溶液,其现象是____ ,说明溶液中含有Fe3+。
(1)向AlCl3溶液中
(2)白色絮状沉淀Fe(OH)2在空气中会迅速的变成灰绿色,最后变成红褐色,原因是发生了化学反应,请写出该反应的化学方程式:
(3)检验溶液中是否含有Fe3+的方法很多。
方法一:向某溶液中加入KSCN溶液,其现象是
方法二:向某溶液中加入NaOH溶液,其现象是
您最近一年使用:0次
2 . 已知甲、乙、丙物质分别由H、C、Na、O、Cl、Fe元素中的一种或几种组成。
(1)若甲物质俗称为小苏打,则甲的化学式为_______ 。
(2)若乙物质在空气中迅速变成灰绿色,最后变成红褐色,,则该反应的化学方程式为_______ 。
(3)若丙物质在常温常压下为黄绿色气体,则实验室制取丙的化学方程式为:_______ 。
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂( )。
)。 的一种制备方法如下。
的一种制备方法如下。

① 中,铁元素的化合价为
中,铁元素的化合价为_______ 价。
②将反应Ⅰ的离子方程式配平:_______ 。
_______ _______
_______ _______
_______ _______
_______ _______
_______
(1)若甲物质俗称为小苏打,则甲的化学式为
(2)若乙物质在空气中迅速变成灰绿色,最后变成红褐色,,则该反应的化学方程式为
(3)若丙物质在常温常压下为黄绿色气体,则实验室制取丙的化学方程式为:
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(
 )。
)。 的一种制备方法如下。
的一种制备方法如下。
①
 中,铁元素的化合价为
中,铁元素的化合价为②将反应Ⅰ的离子方程式配平:
_______
 _______
_______ _______
_______ _______
_______ _______
_______
您最近一年使用:0次
名校
3 . 油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量H2S)的侵蚀,生成PbS而变黑。可用一定量的H2O2溶液擦铁修复。完成下列填空:
(1)H2O2与PbS反应生成PbSO4的和H2O,写出该反应的化学方程式___________ 。
(2)在PbSO4的悬浊液中滴加一定量的CH3COONH4溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,该弱电解质的化学式为___________ 。当PbSO4和CH3COONH4恰好完全反应时,溶液显___________ 性(选填“酸性”、“中性”或“碱性”)。
(3)H2S为二元弱酸,向Na2S溶液中加入FeSO4溶液,生成FeS沉淀,还可能生成白色沉淀,其化学式为___________ ;该物质在空气中很快变为红褐色,原因是___________ 。
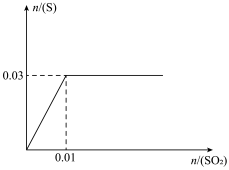
(4)向200mLH2S溶液中缓慢通入SO2,发生反应2H2S+SO2→3S +2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
+2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为___________ 。从开始通SO2至饱和,再继续通一段时间,整个过程中c(H+)的变化情况为___________ 。
(1)H2O2与PbS反应生成PbSO4的和H2O,写出该反应的化学方程式
(2)在PbSO4的悬浊液中滴加一定量的CH3COONH4溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,该弱电解质的化学式为
(3)H2S为二元弱酸,向Na2S溶液中加入FeSO4溶液,生成FeS沉淀,还可能生成白色沉淀,其化学式为
(4)向200mLH2S溶液中缓慢通入SO2,发生反应2H2S+SO2→3S
 +2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
+2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
您最近一年使用:0次
4 . 写出下列反应的现象和方程式
(1)FeCl3溶液中加入过量Fe粉,现象:___________ ;离子方程式:___________ ;该反应中氧化产物与还原产物的物质的量之比为___________ 。
(2)向FeSO4溶液中加入NaOH溶液,现象:___________ ;化学方程式:___________ 。
(1)FeCl3溶液中加入过量Fe粉,现象:
(2)向FeSO4溶液中加入NaOH溶液,现象:
您最近一年使用:0次
解题方法
5 . Na、Fe、Al是中学化学常见的金属元素。回答下列问题:
(1)焰色反应的实验中,Na元素燃烧时的焰色为_______ 色 ,观察K元素燃烧时的焰色需要透过_______ 。
(2)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是_______ ;反应化学方程式为_______ 。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打 (NaHCO3)能治疗胃酸过多,请写出其反应的离子方程式_______ ;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是_______ ;此时最好用含氢氧化铝的胃药(如胃舒平),反应的离子方程式为_______ 。
(1)焰色反应的实验中,Na元素燃烧时的焰色为
(2)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打 (NaHCO3)能治疗胃酸过多,请写出其反应的离子方程式
您最近一年使用:0次
2021-09-03更新
|
190次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
名校
6 . 某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式:___________ 。
(2)物质②为___________ 。
(3)请写出FeCl3溶液与铁粉反应的化学方程式:___________ 。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为___________ ,此过程中发生的氧化还原反应为___________ (用化学方程式表达)。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得胶体,它与FeCl3溶液、Fe(OH)3浊液的本质区别是___________ 。

(1)请写出Fe2O3与①反应的离子方程式:
(2)物质②为
(3)请写出FeCl3溶液与铁粉反应的化学方程式:
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得胶体,它与FeCl3溶液、Fe(OH)3浊液的本质区别是
您最近一年使用:0次
名校
解题方法
7 . 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。

(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A_______ ,B_______ 。
(2)写出上述过程中有关反应的离子方程式:
Fe2O3→A_______ ;
A→B_______ 。
(3)B→C可看到的现象是_______ 。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______ 胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为_______ 。

(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A
(2)写出上述过程中有关反应的离子方程式:
Fe2O3→A
A→B
(3)B→C可看到的现象是
(4)将A的饱和溶液滴入沸水中并不断加热,可制得
您最近一年使用:0次
2021-03-18更新
|
214次组卷
|
10卷引用:云南省峨山彝族自治县第一中学2017-2018学年高一上学期期末考试化学试题
云南省峨山彝族自治县第一中学2017-2018学年高一上学期期末考试化学试题云南省盈江县民族完全中学2019-2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题贵州省罗甸县第一中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市富源县第六中学2019-2020学年高一上学期期末考试化学试题广西壮族自治区崇左市宁明中学2019-2020学年高一上学期期末考试化学试题广西象州县中学2020-2021学年高一上学期12月月考化学试题(已下线)第09练 铁及其化合物-2022年【寒假分层作业】高一化学(人教版2019)陕西省西安市中铁中学2021-2022学年高一上学期第二次考试化学试题广东省肇庆市四会市四会中学、封开县广信中学2023-2024学年高一上学期第二次月考化学试题
8 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)Fe跟Cl2在一定条件下反应,将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成_______ 色。
b.向另一支试管中滴加NaOH溶液,现象为_______ ,反应的离子方程式是_______ 。
(2)若Fe2+溶液中存在Fe3+,除杂的方法是:_______ ;该反应的离子方程式为:_______ 。
(3)Fe(OH)2悬浊液在空气中被氧化的过程现象为___ ,请写出反应的化学方程式_____
(1)Fe跟Cl2在一定条件下反应,将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成
b.向另一支试管中滴加NaOH溶液,现象为
(2)若Fe2+溶液中存在Fe3+,除杂的方法是:
(3)Fe(OH)2悬浊液在空气中被氧化的过程现象为
您最近一年使用:0次
9 . 某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:
(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____ (填序号)。
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为__________________ 。
(3)反应②的化学方程式为___________ 。
(4)反应③发生时观察到的现象是__________ ,用化学方程式表示颜色变化的原因________ 。

(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为
(3)反应②的化学方程式为
(4)反应③发生时观察到的现象是
您最近一年使用:0次
2021-03-04更新
|
185次组卷
|
3卷引用:江西省抚州市金溪县第一中学2020-2021学年高二上学期入学考试化学试题
江西省抚州市金溪县第一中学2020-2021学年高二上学期入学考试化学试题(已下线)第09练 铁及其化合物-2022年【寒假分层作业】高一化学(人教版2019)江西省抚州市金溪县第一中学2021-2022学年高二下学期开学考试化学试题
解题方法
10 . 某学生小组为认识铁及其化合物的性质.分散系的性质做了如下一组综合实验,根据实验流程回答相关问题。

(1)请写出Fe2O3与①反应的离子方程式:_______________________________________ 。
(2)实验室中,检验溶液中存在Fe3+的试剂是__________________ 。
(3)请写出FeCl3与铁粉反应的离子方程式:______________________ 。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________________________ ,此过程中发生的氧化还原反应为(用化学方程式表达)________________________________________________________________________ 。

(1)请写出Fe2O3与①反应的离子方程式:
(2)实验室中,检验溶液中存在Fe3+的试剂是
(3)请写出FeCl3与铁粉反应的离子方程式:
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
您最近一年使用:0次



