解题方法
1 . 按如图所示的方法进行实验,下列有关说法错误的是
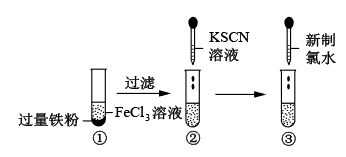

A.①中反应的离子方程式为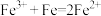 |
B.②中加入 溶液后溶液不变红 溶液后溶液不变红 |
| C.③中加入新制氯水后溶液变红 |
D.氧化性: |
您最近一年使用:0次
2021-06-06更新
|
840次组卷
|
4卷引用:周末培优4 金属及其化合物的实验题和工艺流程题-2021-2022学年高一化学课后培优练(人教版2019必修第一册)
(已下线)周末培优4 金属及其化合物的实验题和工艺流程题-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(苏教版2019)必修第二册专题9 金属与人类文明 易错疑难集训(已下线)新人教必修1第3章第一节第3课时铁盐和亚铁盐(课中)作业(十七) 亚铁盐和铁盐
名校
解题方法
2 . 向一定量的Fe、Fe2O3和CuO混合物投入100mL 0.9mol/L的硫酸溶液中,充分反应后生成448mL标准状况下的气体,得不溶物0.03mol。向滤液中加入2mol/L的NaOH溶液,加至10mL时开始出现沉淀。忽略溶液的体积变化,下列说法不正确的
| A.0.03mol不溶物全为Cu | B.混合物中氧原子的物质的量为0.05mol |
| C.滤液中的阳离子只有两种 | D.滤液中的Fe2+的物质的量浓度为0.8mol/L |
您最近一年使用:0次
2021-02-02更新
|
1433次组卷
|
8卷引用:专题讲座(一) 化学计算的常用方法(精练)-2022年高考化学一轮复习讲练测
(已下线)专题讲座(一) 化学计算的常用方法(精练)-2022年高考化学一轮复习讲练测湖北省沙市中学2020-2021学年高一上学期期末考试化学试题(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)江西省景德镇一中2022-2023学年高一上学期期中考试(19班)化学试题湖北省武汉市第六中学2021-2022学年高一上学期12月月考化学试题重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题湖南省邵阳市第二中学2023-2024学年高一下学期第一次月考化学试题福建师范大学附属中学2021-2022学年高一下学期期末考试化学试题
3 . FeCl3溶液作为腐蚀液制作印刷电路板的原理是,将预先设计好的电路在覆铜板上用蜡覆盖,再把覆铜板放在FeCl3溶液浸泡,蜡没有覆盖到的铜会发生腐蚀反应而溶解,可制得印刷电路板,下列说法不正确的是
| A.FeCl3溶液能与铜反应,与蜡不反应 |
| B.腐蚀反应既是离子反应又是氧化还原反应 |
| C.腐蚀反应说明Cu的还原性比Fe2+强 |
| D.向腐蚀反应后溶液加入一定量铁粉,充分反应后,有固体存在,此时溶液一定不含Fe3+、Cu2+ |
您最近一年使用:0次
4 . 某新型纳米材料氧缺位铁酸盐ZnFe2Ox(3<x<4),能在常温下将工业废气中的SO2、NO2等转化为单质而除去,由锌灰(含ZnO和少量PbO、CuO、Fe2O3等)为主要原料制备氧缺位铁酸盐及其转化废气的流程如图所示,下列说法不正确 的是
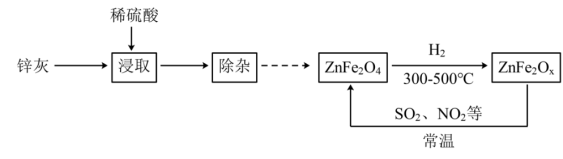

| A.浸取时为了提高酸浸效率,可以搅拌或延长浸取时间 |
| B.“除杂”过程中需要加入足量锌粉等操作,与锌粉反应的金属离子有Fe3+、Cu2+ |
| C.除去SO2时,ZnFe2Ox在反应中表现出氧化性 |
| D.ZnFe2O4与H2反应制得1molZnFe2Ox时,转移的电子物质的量为(8-2x)mol |
您最近一年使用:0次
2022-05-14更新
|
1330次组卷
|
6卷引用:考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)选择题6-10江苏省连云港市2021-2022学年高三高考考前模拟考试(一)化学试题江苏省徐州市2021-2022学年高一下学期期末抽测化学试题江苏省扬州市宝应县2023-2024学年高三上学期期末模拟化学试卷
2020高三·全国·专题练习
名校
解题方法
5 . 下列关于铁及其化合物的说法中错误的是
| A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2 |
| B.铁锈的主要成分可表示为Fe2O3·nH2O |
| C.FeCl3溶液腐蚀铜板的离子方程式为2Fe3++Cu=2Fe2++Cu2+ |
| D.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,则该固体试样中不存在Fe3+ |
您最近一年使用:0次
2020-08-23更新
|
94次组卷
|
3卷引用:第5单元 常见的金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷
(已下线)第5单元 常见的金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷第三章 金属及其化合物 第13讲 铁及其重要化合物天津市第一中学2022-2023学年高三上学期第一次月考化学试题
解题方法
6 . 铋 与氮同主族,在中性及碱性环境下常以
与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为
的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质
,含少量杂质 等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是

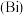 与氮同主族,在中性及碱性环境下常以
与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为
的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质
,含少量杂质 等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
A.“浸出”产生S的主要离子反应为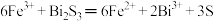 |
| B.“浸出”时盐酸可以还原杂质PbO2 |
| C.“浸出、置换、再生、电解精炼”工序中不全是氧化还原反应 |
| D.再生液可以加入“浸出”操作中循环利用 |
您最近一年使用:0次
2020-12-15更新
|
678次组卷
|
4卷引用:押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)
(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)广东省2021届高三“六校联盟”第二次联考化学试卷湖南省岳阳市2021届高三二模考试化学试题江苏省(天一中学.海门中学.姜堰中学.淮阴中学)四校2021届高三4月联考化学试题
名校
7 . 利用如下实验研究 与
与 的反应。
的反应。
步骤1:向烧杯中加入10mL 0.1 的KI溶液,再滴加2mL 0.1
的KI溶液,再滴加2mL 0.1 的
的 溶液,振荡,把溶液分为四等份于编号为①②③④的四支试管中。
溶液,振荡,把溶液分为四等份于编号为①②③④的四支试管中。
步骤2:向试管①中加入淀粉溶液,观察到溶液变蓝。
步骤3:向试管②中滴加15% KSCN溶液5~6滴,观察到溶液变红。
步骤4:向试管③、试管④中分别加入1mL 2.0 的
的 溶液和1mL的蒸馏水,振荡,观察到试管③中溶液颜色比试管④中溶液颜色浅。
溶液和1mL的蒸馏水,振荡,观察到试管③中溶液颜色比试管④中溶液颜色浅。
下列说法不正确的是
 与
与 的反应。
的反应。步骤1:向烧杯中加入10mL 0.1
 的KI溶液,再滴加2mL 0.1
的KI溶液,再滴加2mL 0.1 的
的 溶液,振荡,把溶液分为四等份于编号为①②③④的四支试管中。
溶液,振荡,把溶液分为四等份于编号为①②③④的四支试管中。步骤2:向试管①中加入淀粉溶液,观察到溶液变蓝。
步骤3:向试管②中滴加15% KSCN溶液5~6滴,观察到溶液变红。
步骤4:向试管③、试管④中分别加入1mL 2.0
 的
的 溶液和1mL的蒸馏水,振荡,观察到试管③中溶液颜色比试管④中溶液颜色浅。
溶液和1mL的蒸馏水,振荡,观察到试管③中溶液颜色比试管④中溶液颜色浅。下列说法不正确的是
A.试管①中的现象说明此条件下 的氧化性大于 的氧化性大于 |
B.试管②中的现象说明 与 与 的反应为可逆反应 的反应为可逆反应 |
C.试管②中红色物质的组成为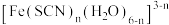 ,此微粒中心离子的配位数为6 ,此微粒中心离子的配位数为6 |
D.步骤4的现象不能说明此条件下 能将 能将 氧化成 氧化成 |
您最近一年使用:0次
2021-05-06更新
|
489次组卷
|
3卷引用:第09讲 铁及其重要化合物(精讲)-2022年一轮复习讲练测
名校
8 . 下列说法中正确的是( )
| A.除去NaCl固体中的少量KNO3,将固体溶解后蒸发结晶,趁热过滤,洗涤,干燥 |
| B.FeCl3可用于腐蚀Cu刻制印刷电路板,这说明铁的金属性比铜强 |
| C.配制质量分数为20 %的NaOH溶液时,需要用到的玻璃仪器为容量瓶、烧杯、玻璃棒 |
| D.工业上用氯气和石灰水反应制漂白粉,保存漂白粉的塑料袋要密封 |
您最近一年使用:0次
2019-11-15更新
|
217次组卷
|
4卷引用:2020届高三化学大二轮增分强化练——卤素及其化合物
名校
解题方法
9 . 为将含FeCl3、FeCl2、CuCl2的废液中的Cu2+还原回收,某同学在含有ag铁粉的容器中加入废液,探究了加入废液体积与完全反应后体系中固体质量的关系,部分实验数据如下表所示。已知:废液中c(Cu2+)=0.7mol·L-1;废液体积大于0.5L,充分反应后才能检测出Cu2+。
下列说法不正确 的是
| 废液体积/L | ≤0.5 | 1 | 2 | 3 | ≥4 |
| 固体质量/g | a | 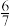 a a | 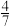 a a | 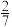 a a | 0 |
| A.当铁粉与0.25L废液反应完全后,固体成分为Fe与Cu |
| B.废液中c(Fe3+)=0.2mol·L-1 |
| C.要将1L废液中的Cu2+全部还原,则至少需要铁粉44.8g |
| D.当铁粉与1L废液反应完全后,再加入废液时发生的离子反应为:Fe+2Fe3+=3Fe2+ |
您最近一年使用:0次
2021-03-12更新
|
138次组卷
|
11卷引用:专题03 铁 金属材料-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)专题03 铁 金属材料-2023年高考化学一轮复习小题多维练(全国通用)【省级联考】浙江省2018-2019学年高二上学期2019年1月学业水平考试化学试题2019-2020学年新新教材同步人教版高中化学必修第一册 (模块)质量检测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题江西省景德镇一中2020-2021学年高一上学期期中考试化学(1班)试题(已下线)【浙江新东方】双师103(已下线)【浙江新东方】高中化学20210304-015湖南省邵阳市第二中学2023-2024学年高一上学期第二次月考化学试题浙江省瑞安中学2023-2024学年高一上学期12月月考化学试卷
名校
解题方法
10 . 某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
下列说法不正确的是( )
| 序号 | I | II | III |
| 实验步骤 | 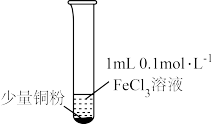 充分振荡,加2mL蒸馏水 |  充分振荡,加入2mL蒸馏水 | 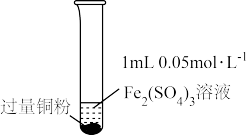 充分振荡,加入2mL蒸馏水 |
| 实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去, 变成蓝色,加入蒸馏水后无白色沉淀 |
| A.实验I、II、III中均发生了反应2Fe3++Cu=2Fe2++Cu2+ |
| B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关 |
| C.实验I、III中加入蒸馏水后c(Cu2+)相同 |
| D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀 |
您最近一年使用:0次
2020-07-06更新
|
227次组卷
|
7卷引用:第7讲 铁及其化合物-2021年高考化学一轮复习名师精讲练



