名校
解题方法
1 . 现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)充分反应后,溶液中存在4.8g不溶物的成分为___________ (用化学式表示)。
(2)充分反应后溶液中一定不存在的金属离子为___________ 。
(3)比较 、
、 、
、 的氧化性大小:
的氧化性大小:___________ 。
(4)试计算最后溶液中 离子的物质的量浓度
离子的物质的量浓度___________ mol/L。
(1)充分反应后,溶液中存在4.8g不溶物的成分为
(2)充分反应后溶液中一定不存在的金属离子为
(3)比较
 、
、 、
、 的氧化性大小:
的氧化性大小:(4)试计算最后溶液中
 离子的物质的量浓度
离子的物质的量浓度
您最近半年使用:0次
14-15高三上·辽宁沈阳·期末
名校
解题方法
2 . 为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计不合理的是

| A.④ | B.③ |
| C.③④ | D.①②③④⑤ |
您最近半年使用:0次
2023-08-16更新
|
918次组卷
|
43卷引用:2014届辽宁省新民市第一高级中学高三上学期期末考试化学试卷
(已下线)2014届辽宁省新民市第一高级中学高三上学期期末考试化学试卷(已下线)2015届宁夏银川市唐徕回民中学高三上学期期中考试化学试卷2014-2015天津市和平区高一上学期期末考试化学试卷2015-2016学年福建省龙海二中高二下学期期末化学试卷2017届吉林省汪清六中高三上第二次月考化学试卷2016-2017学年河北石家庄辛集中学高一上阶段考二化学卷河北省辛集中学2017-2018学年高一上学期12月月考化学试题河南省商丘市第一高级中学2017-2018学年高一上学期第二次月考化学试题黑龙江省大庆第一中学2017-2018学年高一上学期期末考试化学试题广西陆川县中学2017-2018学年高一上学期期末考试化学试题吉林省柳河中学2017-2018学年高一上学期期末考试化学试题【校级联考】天津市静海区2019届高三上学期三校联考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高一上学期第二次月考化学试题内蒙古自治区翁牛特旗乌丹第一中学2018-2019学年高一上学期期中考试化学试题山东省莒县第一中学2018-2019学年高一上学期12月月考化学试题西藏自治区拉萨市那曲第二高级中学2019-2020学年高一上学期期末考试化学试题河北省张家口市宣化区第一中学2019-2020学年高一3月月考化学试题江西省临川第一中学2019-2020学年高一上学期12月月考化学试题人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物(已下线)第三章 铁 金属材料(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)北京首都师范大学第二附属中学2021届高三9月月考化学试题(已下线)3.2.3 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)3.1.2 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)云南省普洱市景东彝族自治县第一中学2020-2021学年高一上学期月考化学试题江西省会昌中学2020-2021学年高一上学期第二次月考化学试题江西省新余市第四中学2020-2021学年高一上学期第二次段考化学试题云南省文山州砚山县第三高级中学2020-2021学年高一12月月考化学试题(已下线)3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)上海市控江中学2021-2022学年高二上学期第一次月考化学试卷吉林省长春外国语学校2021-2022学年高一上学期第二次月考化学试题(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)新疆乌鲁木齐市第四中学2021-2022学年高一上学期期末考试化学试题河北省辛集市第一中学2021-2022学年高一上学期第四次月考化学试题宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题(已下线)第12讲 铁、亚铁盐和铁盐-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)云南省大理市黄冈实验中学2021-2022学年高一上学期12月月考化学试题第2课时 铁盐和亚铁盐第1课时 亚铁盐和铁盐安徽省合肥市第三中学2023-2024学年高一上学期12月份学情调研化学试题天津北京师范大学静海附属学校 (天津市静海区北师大实验学校)2023-2024学年高三上学期第二次阶段检测(期中)化学试题
名校
3 . 已知在溶液中能发生反应:2FeCl3+Cu=2FeCl2+CuCl2。向氯化铁和氯化铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,向滤出的固体加入少量稀硫酸,无气泡产生。则下列说法正确的是
| A.滤出的固体中不含铁,滤液中含氯化铁 |
| B.滤液中一定含有氯化亚铁和氯化铜 |
| C.滤液中一定含有氯化亚铁,可能含有氯化铜 |
| D.滤出的固体是铜,滤液中一定没有氯化铁 |
您最近半年使用:0次
名校
解题方法
4 . 在 和
和 的混合溶液中加入铁粉,充分反应后有固体剩余,经过滤后滤液中的可能含有的离子有
的混合溶液中加入铁粉,充分反应后有固体剩余,经过滤后滤液中的可能含有的离子有
① ②
② 和
和 ③
③ 和
和 ④
④ 和
和
 和
和 的混合溶液中加入铁粉,充分反应后有固体剩余,经过滤后滤液中的可能含有的离子有
的混合溶液中加入铁粉,充分反应后有固体剩余,经过滤后滤液中的可能含有的离子有①
 ②
② 和
和 ③
③ 和
和 ④
④ 和
和
| A.①③ | B.②④ | C.①④ | D.②③ |
您最近半年使用:0次
2022-12-11更新
|
674次组卷
|
27卷引用:2015-2016学年山西省大同一中高一上期末考试化学试卷
2015-2016学年山西省大同一中高一上期末考试化学试卷2015-2016学年山西省怀仁一中高一下第一次月考化学试卷2016-2017学年河北省张家口市第一中学高一(衔接班)上学期期中(理)化学试卷陕西省黄陵中学高新部2018届高三上学期期中考试化学试题2019届高三化学(铁、铜及其化合物)一轮复习针对训练题海南省桥中三亚学校2019届高三上学期第二次月考化学试题【全国百强校】山东省泰安市第一中学2018-2019学年高一上学期期中考试化学试题吉林省白城市通榆县第一中学2020届高三上学期第二次月考化学试题黑龙江省齐齐哈尔市龙江二中2019-2020学年高一上学期12月月考化学试题安徽省滁州市定远县育才学校2019-2020学年高一(普通班)上学期第三次月考化学试题四川省成都市新津中学2019-2020学年高一12月月考化学试题甘肃省玉门市油田第一中学2020-2021学年高一上学期期末考试化学试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高三上学期第一次月考化学试题 河北省邢台市南宫中学2022-2023学年高一上学期第三次月考化学试题山东省济南第三中学2022-2023学年高一上学期12月月考化学试题河北省邢台市第一中学2022-2023学年高一上学期第三次月考化学试题北京市北京师范大学第二附属中学2022-2023学年高一上学期12月月考化学试题重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题吉林省长春市第五中学2022-2023学年高一上学期期末考试化学试题江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题河南省南阳市2022-2023学年高一上学期1月期末考试化学试题新疆维吾尔自治区塔城市第三中学2022-2023学年高一上学期11月期中化学试题广东省肇庆市封开县广信中学、四会中学2023-2024学年高一上学期第一次联考化学试题(已下线)专题06 铁、铝及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)河南省南阳市唐河县第一高级中学2023-2024学年高一上学期12月月考化学试题吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高一上学期1月期末化学试题浙江省绍兴一中2023-2024学年高二上学期期末考试化学试题
名校
5 . 下列说法不正确 的是
| A.液氯可以储存在钢瓶中 | B.次氯酸钙是漂白粉的有效成分 |
| C.考古时利用12C测定文物的年代 | D.氯化铁溶液可用于制作印刷铜电路板 |
您最近半年使用:0次
2022-10-30更新
|
105次组卷
|
2卷引用:浙江省湖州市吴兴高级中学2020-2021学年高一上学期12月月考化学试题
2009·辽宁抚顺·二模
名校
解题方法
6 . 将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
您最近半年使用:0次
2022-09-06更新
|
1611次组卷
|
49卷引用:辽宁省抚顺市六校联合体2009—2010学年度高三二模(理综)试题化学部分
(已下线)辽宁省抚顺市六校联合体2009—2010学年度高三二模(理综)试题化学部分(已下线)2010年杭州市西湖高级中学高三上学期开学考试化学试题(已下线)2011-2012学年广东省中山市高一上学期期末统一考试化学试卷(已下线)2011-2012学年黑龙江哈六中高一上学期期末考试化学试卷(已下线)2013届山西省长治二中高三上学期第一次练考化学试卷(已下线)2013届福建安溪一中、养正中学高三上学期期中联考化学试卷(已下线)2012-2013学年吉林省长春二中高一上学期期末考试化学试卷(已下线)2012-2013学年陕西省西安市高陵县第三中学高一第三次月考化学试卷(已下线)2012-2013学年广东省深圳科学高中高一第一学期期末考试化学试卷B(已下线)2013-2014学年河北冀州中学高一上学期第四次月考化学试卷2015-2016学年湖北省汉川市高一上学期期末考试化学试卷2015-2016学年黑龙江省海林林业局一中高一上学期期末化学试卷2016-2017学年河北省张家口第一中学高一(普通班、实验班)下学期开学检测化学试卷河北省辛集中学2017-2018学年高一上学期12月月考化学试题宁夏银川一中2017-2018学年高一上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题北京四中2017-2018学年高一上学期期末考试化学试题【全国百强校】浙江省嘉兴市第一中学2017-2018学年高一下学期期中考试化学试题陕西省汉中市汉中中学2019届高三上学期第二次月考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高一上学期第二次月考化学试题湖南省双峰县第七中学2018-2019学年高一第一学期第三次月考化学试题吉林省扶余市第一中学2018-2019学年高一上学期期末考试化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题【全国百强校】北京市第四中学2018-2019学年高一上学期期末考试化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期开学考试化学试题江西省南城县第二中学2018-2019学年高一12月月考化学试题黑龙江省安达市第七中学2019-2020学年高一上学期月考化学试题鲁教版高中化学必修1第四章《材料家族中的元素》测试卷2(已下线)【新东方】2020-80.湖北省武汉外国语学校2019-2020学年高一上学期期末考试化学试题人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 课时2 铁盐、亚铁盐鲁科版(2019)高一必修第一册第三章第1节 铁的多样性 课时2 铁及其化合物之间的转化关系高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮河南省长葛市第一高级中学2020-2021学年高一上学期阶段性测试试卷化学试题(已下线)第三章 金属及其化合物(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)3.2.3 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)河南省豫西名校2020-2021学年高一上学期第二次联考化学试题河北省石家庄二中2019-2020学年高一上学期期末考试化学试题上海市杨浦高级中学2020-2021学年高二上学期第一次月考化学试题四川宜宾屏山县中学校2020-2021学年高一下学期第一次月考化学试题河北省邯郸市大名县第一中学2020-2021学年高一下学期5月月考化学试题(已下线)微专题13 亚铁离子、三价铁离子的性质及检验-备战2022年高考化学考点微专题甘肃省武威第七中学2022-2023学年高三上学期第一次质量检测化学试题(已下线)3.2.2物质的量在化学方程式中的计算-同步学习必备知识辽宁省铁岭市昌图县第一高级中学2022-2023学年高一上学期12月化学试题甘肃天祝藏族自治县第一中学2022-2023学年高一上学期期末考试化学试题陕西省咸阳市2022-2023学年高一上学期期末考试化学试题湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题山东省聊城市临清市第一中学2023-2024学年高一上学期期末模拟考试化学试题
11-12高三·安徽安庆·阶段练习
名校
解题方法
7 . 在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是
| A.将残余固体加入到稀H2SO4中,有气泡 | B.最后得到的溶液中可能含有Fe3+ |
| C.残余固体是铜和铁 | D.最后得到的溶液中一定含有Cu2+ |
您最近半年使用:0次
2022-08-21更新
|
126次组卷
|
24卷引用:2013届安徽省望江二中高三第三次月考化学试卷
(已下线)2013届安徽省望江二中高三第三次月考化学试卷2015届湖南省岳阳县一中高三上学期第三次月考化学试卷2016-2017学年广东省汕头市金山中学高一上学期期末考试化学试卷福建省永安市第三中学2019届高三上学期第三次(12月)月考化学试题【全国百强校】安徽省合肥市第六中学2018-2019学年高一下学期开学考试化学试题安徽省滁州市定远县育才学校2019-2020学年高二上学期入学考试化学试题山西省应县第一中学校2019-2020学年高一上学期第四次月考化学试题山西省太原市山西大学附属中学2019-2020学年高一上学期12月月考化学试题辽宁省瓦房店市高级中学2019-2020学年高一下学期期末考试化学试题(已下线)3.1.2 铁的氢氧化物 铁盐和亚铁盐练习(1)——《高中新教材同步备课》(人教版 必修第一册)(已下线)3.1.2 铁及其化合物之间的转化关系练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 易错疑难集训江西省上饶市横峰中学、铅山一中、弋阳一中2020-2021学年高二上学期开学联考化学试题(课改班)(已下线)3.1.2 铁的重要化合物-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)湖南省常德市第一中学2020-2021学年高一上学期第2次月考化学试题(已下线)新人教必修1第3章第一节第3课时铁盐和亚铁盐(课后)(已下线)3.1.3 铁盐和亚铁盐-2021-2022学年高一化学10分钟课前预习练(人教版2019必修第一册)辽宁省渤海大学附属高级中学2021-2022学年高一上学期第二次月考化学试题陕西省西安市长安区第一中学2021-2022学年高一上学期期末考试化学试题(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)作业(十七) 亚铁盐和铁盐云南省玉溪第三中学2022-2023学年高一下学期期末考试化学试题宁夏银川市唐徕中学2023-2024学年高三上学期9月月考化学试题浙江省杭州市源清中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
8 . 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后铁完全反应,溶液中不存在Fe3+,同时析出0.1molAg。则下列结论中不正确的是
| A.反应后溶液中Cu2+与Fe2+的物质的量比为1∶2 |
| B.氧化性:Fe3+>Cu2+>Ag+ |
| C.含Fe3+的溶液可腐蚀铜板 |
| D.1molFe可还原2molFe3+ |
您最近半年使用:0次
2021-10-07更新
|
287次组卷
|
4卷引用:安徽省滁州市定远县炉桥中学2020-2021学年高一上学期第一次质量检测化学试题
安徽省滁州市定远县炉桥中学2020-2021学年高一上学期第一次质量检测化学试题(已下线)3.1.1 铁及其化合物-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)四川省泸县第四中学2022-2023学年高一上学期期末考试化学试题四川省泸县第四中学2022-2023学年高一下学期开学考试化学试题
名校
9 . 铜及其化合物在生产、生活中有广泛的应用。
(1)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2·2H2O,实验室模拟回收过程如图:
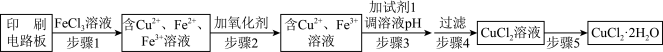
①步骤1的离子方程式为_______ ,证明步骤1所加FeCl3溶液过量的方法是_______ 。
②步骤2中所加的氧化剂较适宜的有_______ 。
A.HNO3 B.H2O2 C.KMnO4 D.氯水
写出加氧化剂相关的离子方程式_______ (写一个即可)。
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的试剂1是_______ 。(填选项)
A.NH3·H2O B.NaOH C.Cu(OH)2
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是_______ (写出离子反应方程式并结合简要的文字说明),再经_______ (某实验操作方法)、过滤得到CuCl2·2H2O。
(2)方法二:用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) ∆H1=-320kJ/mol
又知:2H2O2(l)=2H2O(l)+O2(g) ∆H2=-196kJ/mol
H2(g)+ O2(g)=H2O(l) ∆H3=-286kJ/mol
O2(g)=H2O(l) ∆H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的∆H=_______ 。
(1)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2·2H2O,实验室模拟回收过程如图:
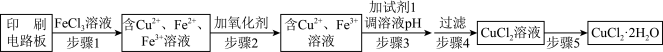
①步骤1的离子方程式为
②步骤2中所加的氧化剂较适宜的有
A.HNO3 B.H2O2 C.KMnO4 D.氯水
写出加氧化剂相关的离子方程式
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的试剂1是
A.NH3·H2O B.NaOH C.Cu(OH)2
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是
(2)方法二:用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) ∆H1=-320kJ/mol
又知:2H2O2(l)=2H2O(l)+O2(g) ∆H2=-196kJ/mol
H2(g)+
 O2(g)=H2O(l) ∆H3=-286kJ/mol
O2(g)=H2O(l) ∆H3=-286kJ/mol则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的∆H=
您最近半年使用:0次
2021-09-07更新
|
134次组卷
|
2卷引用:甘肃省嘉峪关市第一中学2021届高三上学期一模考试化学试卷
名校
10 . 已知:Fe3+溶液颜色为黄色,Fe2+溶液颜色为浅绿色,Fe(OH)3为红褐色。
(1)现将少量Fe2O3粉末加入适量稀盐酸,发生反应的离子方程式___________ ,用所得溶液进行以下实验:
(2)取少量溶液于试管中,滴入NaOH溶液,观察到有红褐色沉淀生成,反应的离子方程式为___________ 。
(3)取少量溶液于试管中,加入少量还原铁粉,振荡,铁粉逐渐溶解,溶液由黄色变为浅绿色,反应的离子方程式为___________ 。
(4)在烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中滴加几滴FeCl3饱和溶液,继续煮沸直到溶液呈红褐色,即得到Fe(OH)3胶体。取少量Fe(OH)3胶体,逐滴加入盐酸至过量,向观察到的现象是:先出现红褐色沉淀,然后___________ , 对后一现象的解释是(用离子方程式表示)___________ 。
(1)现将少量Fe2O3粉末加入适量稀盐酸,发生反应的离子方程式
(2)取少量溶液于试管中,滴入NaOH溶液,观察到有红褐色沉淀生成,反应的离子方程式为
(3)取少量溶液于试管中,加入少量还原铁粉,振荡,铁粉逐渐溶解,溶液由黄色变为浅绿色,反应的离子方程式为
(4)在烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中滴加几滴FeCl3饱和溶液,继续煮沸直到溶液呈红褐色,即得到Fe(OH)3胶体。取少量Fe(OH)3胶体,逐滴加入盐酸至过量,向观察到的现象是:先出现红褐色沉淀,然后
您最近半年使用:0次



