1 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Cu+ [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为___________ 。
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是___________ 。
②实验表明假设b合理,实验I反应的离子方程式有___________ 、 。
。
(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-___________ 。
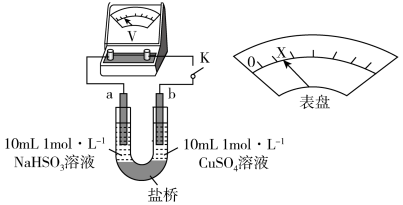
下述实验III证实了假设合理,装置如下图。___________ (补全实验操作及现象)。
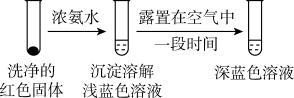
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和 。
。
①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是___________ 。___________ 。
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:___________ 。
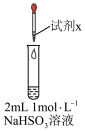
| 实验 | 装置 | 试剂x | 操作及现象 |
| I |
| 1 mol/LCuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅 |
| II | 1 mol/LCuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化 |
 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
 。
。(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-
下述实验III证实了假设合理,装置如下图。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和
 。
。①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:
您最近半年使用:0次
名校
2 . 硝酸铜是一种重要的化工原料,可由工业含铜废料制备,含铜废料的主要成分为 等,制备流程如图所示:
等,制备流程如图所示:
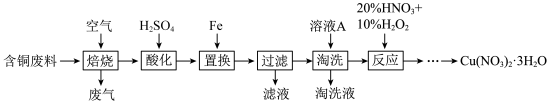
回答下列问题:
(1)焙烧时, 与空气中的
与空气中的 反应生成
反应生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)“淘洗”所用的溶液A可以是___________ 。(填标号)。
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.浓硫酸
(3)“反应”阶段所用的试剂是20%的 溶液和10%的
溶液和10%的 溶液,反应过程中无红棕色气体生成。
溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的 和
和 的物质的量之比为
的物质的量之比为___________ 。
②若不加10%的 溶液,只用20%的
溶液,只用20%的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为___________ 。
③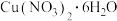 和
和 的溶解度如图所示。从“反应”阶段所得溶液中析出
的溶解度如图所示。从“反应”阶段所得溶液中析出 的方法是
的方法是___________ 。
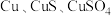 等,制备流程如图所示:
等,制备流程如图所示:
回答下列问题:
(1)焙烧时,
 与空气中的
与空气中的 反应生成
反应生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(2)“淘洗”所用的溶液A可以是
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.浓硫酸
(3)“反应”阶段所用的试剂是20%的
 溶液和10%的
溶液和10%的 溶液,反应过程中无红棕色气体生成。
溶液,反应过程中无红棕色气体生成。①理论上反应所消耗的
 和
和 的物质的量之比为
的物质的量之比为②若不加10%的
 溶液,只用20%的
溶液,只用20%的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为③
 和
和 的溶解度如图所示。从“反应”阶段所得溶液中析出
的溶解度如图所示。从“反应”阶段所得溶液中析出 的方法是
的方法是
您最近半年使用:0次
名校
3 . 某兴趣小组用硫酸铜制备硫酸四氨合铜([Cu(NH3)4]SO4·H2O,M=246g/mol),并对产品的纯度进行了测定。
实验一:硫酸四氨合铜的制备
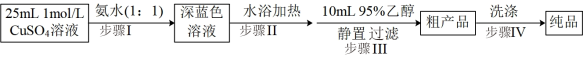
实验二:硫酸四氨合铜纯度测定
步骤①:准确称取mg固体于烧杯中,加稀硫酸溶解,再定容至250mL
步骤②:量取上述试液25.00mL于锥形瓶中,加入100mL水和KI固体(稍过量)
步骤③:用Na2S2O3标准溶液(0.1mol/L)滴定至溶液呈淡黄色,加入淀粉溶液2mL,溶液变为蓝黑色,再加入10%KSCN溶液10mL,继续用Na2S2O3标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为VmL。
已知:①[Cu(NH3)4]SO4·H2O溶于水。
②[Cu(NH3)4]2+ Cu2++4NH3,2Cu2++4I-=2CuI↓+I2,CuI沉淀表面易吸附I2。
Cu2++4NH3,2Cu2++4I-=2CuI↓+I2,CuI沉淀表面易吸附I2。
③CuSCN比CuI更难溶。
④I2+2 =
= +2I-。
+2I-。
请回答:
(1)硫酸四氨合铜的制备过程中,步骤I的反应中先生成沉淀再溶解,该步骤中的离子方程式为___________ 。步骤Ⅲ中加入95%乙醇能降低溶质溶解度的原因___________ 。
(2)下列说法正确的是___________ 。
A.配制250mL溶液的实验中用到的玻璃仪器只包括烧杯、玻璃棒、250mL容量瓶
B.滴定时,加入KSCN的目的是把CuI吸附的I2释放出来
C.上述测定过程提及的仪器中容量瓶、锥形瓶,在使用前一定不能润洗
D.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
E.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
(3)硫酸四氨合铜纯度测定过程中:
①Cu2+与I-反应时,pH不能过高,给出两点理由:___________ 。
②滴定前。有关滴定管的正确操作为 (选出正确操作并按序排列):___________ 。
检漏→蒸馏水洗涤→___________→___________→___________→___________→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液 E记录起始读数 F.用滴定液润洗2至3次 G.排除气泡
③在横线上补全滴定管润洗的操作:从滴定管上口加3~5mL所要盛装的酸或碱,___________ 。然后,一手控制活塞(轻轻转动酸式滴定管的活塞:或者轻轻挤压碱式滴定管中的玻璃球),将液体从滴定管下部放入预置的烧杯中。重复2~3次。
④硫酸四氨合铜纯度是___________ (用m、V表示)。
实验一:硫酸四氨合铜的制备

实验二:硫酸四氨合铜纯度测定
步骤①:准确称取mg固体于烧杯中,加稀硫酸溶解,再定容至250mL
步骤②:量取上述试液25.00mL于锥形瓶中,加入100mL水和KI固体(稍过量)
步骤③:用Na2S2O3标准溶液(0.1mol/L)滴定至溶液呈淡黄色,加入淀粉溶液2mL,溶液变为蓝黑色,再加入10%KSCN溶液10mL,继续用Na2S2O3标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为VmL。
已知:①[Cu(NH3)4]SO4·H2O溶于水。
②[Cu(NH3)4]2+
 Cu2++4NH3,2Cu2++4I-=2CuI↓+I2,CuI沉淀表面易吸附I2。
Cu2++4NH3,2Cu2++4I-=2CuI↓+I2,CuI沉淀表面易吸附I2。③CuSCN比CuI更难溶。
④I2+2
 =
= +2I-。
+2I-。请回答:
(1)硫酸四氨合铜的制备过程中,步骤I的反应中先生成沉淀再溶解,该步骤中的离子方程式为
(2)下列说法正确的是
A.配制250mL溶液的实验中用到的玻璃仪器只包括烧杯、玻璃棒、250mL容量瓶
B.滴定时,加入KSCN的目的是把CuI吸附的I2释放出来
C.上述测定过程提及的仪器中容量瓶、锥形瓶,在使用前一定不能润洗
D.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
E.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
(3)硫酸四氨合铜纯度测定过程中:
①Cu2+与I-反应时,pH不能过高,给出两点理由:
②滴定前。有关滴定管的正确操作为 (选出正确操作并按序排列):
检漏→蒸馏水洗涤→___________→___________→___________→___________→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液 E记录起始读数 F.用滴定液润洗2至3次 G.排除气泡
③在横线上补全滴定管润洗的操作:从滴定管上口加3~5mL所要盛装的酸或碱,
④硫酸四氨合铜纯度是
您最近半年使用:0次
23-24高一下·吉林·开学考试
名校
4 . 现有部分被氧化的Fe、Cu混合物(氧化物为 、CuO)样品共5.60g,经如下处理:
、CuO)样品共5.60g,经如下处理:
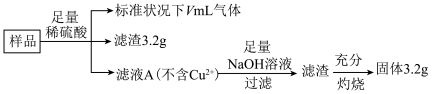
下列说法错误的是
 、CuO)样品共5.60g,经如下处理:
、CuO)样品共5.60g,经如下处理:
下列说法错误的是
| A.V=672 |
B.滤液A中的阳离子为 、 、 |
| C.样品中氧元素的物质的量为0.01mol |
| D.溶解样品的过程中消耗硫酸的总物质的量为0.05mol |
您最近半年使用:0次
5 . 下表中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述I | 陈述II | 判断 |
| A | 碳酸钠溶液显碱性 | 碳酸钠可做胃酸中和剂 | I对,II对,无 |
| B | Fe2+可以与酸性 KMnO4 发生氧化还原反应,能使酸性高锰酸钾溶液褪色 | 用酸性 KMnO4 溶液检验 Fe2(SO4)3溶液中是否含有 FeSO4 | I对,II对,有 |
| C | 铝单质既能与盐酸反应放出氢气,又能与氢氧化钠溶液反应放出氢气 | 常温下铝制容器可以盛装浓硫酸 | I对,II对,有 |
| D | 铜绿的主要成分是碱式碳酸铜,碱式碳酸铜能溶于稀盐酸 | 可用盐酸除去铜器表面的铜绿 | I对,II错,无 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
6 . 硫酸铜晶体、硫酸四氨合铜晶体 均是常见的含铜化合物,可以由铜或含铜矿物制取得到。
均是常见的含铜化合物,可以由铜或含铜矿物制取得到。
(1)兴趣小组用图所示装置进行硫酸铜的制备,二连球的作用是鼓入空气。CuCl是白色难溶于水的固体, 是墨绿色难溶于水的固体。
是墨绿色难溶于水的固体。
①三颈烧瓶中主要涉及三个反应,写出反应Ⅱ的化学方程式。
反应Ⅰ.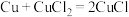
反应Ⅱ.___________
反应Ⅲ.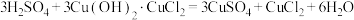
②按如图所示装置连接并加好试剂后,进行如下操作:
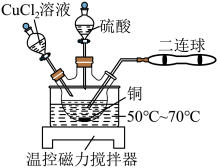
操作1:向三颈烧瓶中加入一定量的 溶液,充分搅拌至有大量白色固体生成;
溶液,充分搅拌至有大量白色固体生成;
操作2:鼓入空气,待有大量墨绿色固体生成后,滴加稀硫酸至墨绿色固体完全溶解;
重复操作2至铜完全溶解。
操作1中加入 溶液不能过多的原因是
溶液不能过多的原因是___________ ,也不能过少的原因是___________ 。
③Cu和浓硫酸直接反应也可制取硫酸铜,与上述实验方案相比,Cu和浓硫酸直接反应制取硫酸铜的缺点有___________ 和___________ 。
(2)黄铜矿(主要成分为 )可用于制取
)可用于制取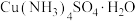 晶体。将黄铜矿在有氧条件下用硫酸浸出,所得浸出液中含有
晶体。将黄铜矿在有氧条件下用硫酸浸出,所得浸出液中含有 、
、 和
和 。设计由浸出液制取
。设计由浸出液制取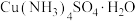 晶体的实验方案:
晶体的实验方案:___________ ,得到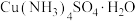 晶体。(实验中须使用的试剂有:1 mol⋅L-1氨水、
晶体。(实验中须使用的试剂有:1 mol⋅L-1氨水、 溶液、3%
溶液、3% 溶液、无水乙醇)
溶液、无水乙醇)
已知Ⅰ.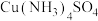 加热时易失去
加热时易失去
Ⅱ.实验中金属离子开始沉淀为氢氧化物及沉淀完全的pH如下表所示:
 均是常见的含铜化合物,可以由铜或含铜矿物制取得到。
均是常见的含铜化合物,可以由铜或含铜矿物制取得到。(1)兴趣小组用图所示装置进行硫酸铜的制备,二连球的作用是鼓入空气。CuCl是白色难溶于水的固体,
 是墨绿色难溶于水的固体。
是墨绿色难溶于水的固体。①三颈烧瓶中主要涉及三个反应,写出反应Ⅱ的化学方程式。
反应Ⅰ.
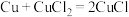
反应Ⅱ.
反应Ⅲ.
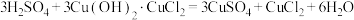
②按如图所示装置连接并加好试剂后,进行如下操作:

操作1:向三颈烧瓶中加入一定量的
 溶液,充分搅拌至有大量白色固体生成;
溶液,充分搅拌至有大量白色固体生成;操作2:鼓入空气,待有大量墨绿色固体生成后,滴加稀硫酸至墨绿色固体完全溶解;
重复操作2至铜完全溶解。
操作1中加入
 溶液不能过多的原因是
溶液不能过多的原因是③Cu和浓硫酸直接反应也可制取硫酸铜,与上述实验方案相比,Cu和浓硫酸直接反应制取硫酸铜的缺点有
(2)黄铜矿(主要成分为
 )可用于制取
)可用于制取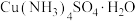 晶体。将黄铜矿在有氧条件下用硫酸浸出,所得浸出液中含有
晶体。将黄铜矿在有氧条件下用硫酸浸出,所得浸出液中含有 、
、 和
和 。设计由浸出液制取
。设计由浸出液制取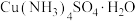 晶体的实验方案:
晶体的实验方案: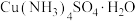 晶体。(实验中须使用的试剂有:1 mol⋅L-1氨水、
晶体。(实验中须使用的试剂有:1 mol⋅L-1氨水、 溶液、3%
溶液、3% 溶液、无水乙醇)
溶液、无水乙醇)已知Ⅰ.
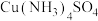 加热时易失去
加热时易失去
Ⅱ.实验中金属离子开始沉淀为氢氧化物及沉淀完全的pH如下表所示:
 |  |  | |
| 开始沉淀的pH | 1.9 | 4.7 | 5.8 |
| 沉淀完全的pH | 3.2 | 6.7 | 9.0 |
您最近半年使用:0次
2024-02-24更新
|
282次组卷
|
2卷引用:江苏省 徐州市第七中学2023-2024学年高三上学期12月月考化学试题
7 . 废弃的锂离子电池中含有多种金属元素,需回收处理。柠檬酸因具有酸性和较好的络合性,可用于浸出金属离子并得到柠檬酸浸出液。下图是某小组研究从柠檬酸浸出液中分离出铜并制备碱式碳酸铜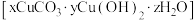 的制备流程。
的制备流程。

(1)在“调pH分离铜”的步骤中,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小于理论分析结果,可能的原因为___________ 。
(2)在“还原法沉铜”的步骤中,利用抗坏血酸(C6H8O6)能有效的将Cu(Ⅱ)还原成金属Cu。抗坏血酸(C6H8O6)易被氧化为脱氢抗坏血酸(C6H6O6);且受热易分解。
①抗坏血酸还原 的离子方程式为
的离子方程式为___________ 。
②某实验小组研究了相同条件下温度对Cu沉淀率的影响。从如图可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降,下降可能的原因是___________ 。

(3)将所得铜粉制备为 溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始:
溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始: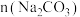 与
与 的比值和溶液pH的关系如图所示。
的比值和溶液pH的关系如图所示。
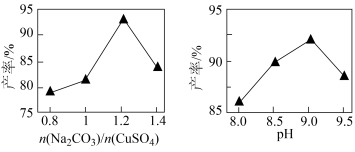
①补充完整由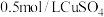 溶液制取碱式碳酸铜的实验方案:向烧杯中加入
溶液制取碱式碳酸铜的实验方案:向烧杯中加入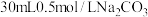 溶液,将烧杯置于70℃的水浴中,
溶液,将烧杯置于70℃的水浴中,___________ ,低温烘干,得到碱式碳酸铜(实验中可选用的试剂或仪器: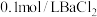 溶液、0.1mol/LNaOH溶液、0.1mol/L盐酸、pH计)。
溶液、0.1mol/LNaOH溶液、0.1mol/L盐酸、pH计)。
②实验时发现,若反应时溶液pH过大,所得碱式碳酸铜的产率偏低,但产品中Cu元素含量偏大,原因是___________ 。
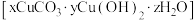 的制备流程。
的制备流程。
(1)在“调pH分离铜”的步骤中,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小于理论分析结果,可能的原因为
(2)在“还原法沉铜”的步骤中,利用抗坏血酸(C6H8O6)能有效的将Cu(Ⅱ)还原成金属Cu。抗坏血酸(C6H8O6)易被氧化为脱氢抗坏血酸(C6H6O6);且受热易分解。
①抗坏血酸还原
 的离子方程式为
的离子方程式为②某实验小组研究了相同条件下温度对Cu沉淀率的影响。从如图可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降,下降可能的原因是

(3)将所得铜粉制备为
 溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始:
溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始: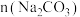 与
与 的比值和溶液pH的关系如图所示。
的比值和溶液pH的关系如图所示。
①补充完整由
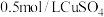 溶液制取碱式碳酸铜的实验方案:向烧杯中加入
溶液制取碱式碳酸铜的实验方案:向烧杯中加入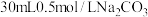 溶液,将烧杯置于70℃的水浴中,
溶液,将烧杯置于70℃的水浴中,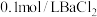 溶液、0.1mol/LNaOH溶液、0.1mol/L盐酸、pH计)。
溶液、0.1mol/LNaOH溶液、0.1mol/L盐酸、pH计)。②实验时发现,若反应时溶液pH过大,所得碱式碳酸铜的产率偏低,但产品中Cu元素含量偏大,原因是
您最近半年使用:0次
名校
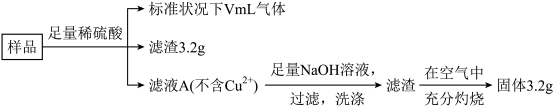
8 . 部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
已知:氯化铁溶液用于腐蚀印刷电路铜板的离子反应为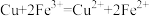 。下列说法正确的是
。下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中氧原子的物质的量为0.02mol
③溶解样品的过程中消耗H2SO4的总物质的量为0.04mol④V=224⑤V=448

已知:氯化铁溶液用于腐蚀印刷电路铜板的离子反应为
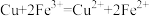 。下列说法正确的是
。下列说法正确的是①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中氧原子的物质的量为0.02mol
③溶解样品的过程中消耗H2SO4的总物质的量为0.04mol④V=224⑤V=448
| A.①③④ | B.②③④ | C.②③⑤ | D.①②⑤ |
您最近半年使用:0次
名校
9 . 冶炼铜时可使 在高温下与
在高温下与 反应转化为
反应转化为 ,生成的
,生成的 与
与 进一步反应得到
进一步反应得到 。
。 在酸性溶液中会转化为
在酸性溶液中会转化为 和
和 ;
; 能被浓硝酸氧化为
能被浓硝酸氧化为 。
。 在
在 存在下能与氨水反应生成
存在下能与氨水反应生成 。则下列化学反应表示正确的是
。则下列化学反应表示正确的是
 在高温下与
在高温下与 反应转化为
反应转化为 ,生成的
,生成的 与
与 进一步反应得到
进一步反应得到 。
。 在酸性溶液中会转化为
在酸性溶液中会转化为 和
和 ;
; 能被浓硝酸氧化为
能被浓硝酸氧化为 。
。 在
在 存在下能与氨水反应生成
存在下能与氨水反应生成 。则下列化学反应表示正确的是
。则下列化学反应表示正确的是A. 在高温下与 在高温下与 反应: 反应: |
B. 与浓硝酸反应: 与浓硝酸反应: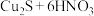 (浓) (浓)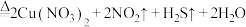 |
C. 溶于稀硫酸: 溶于稀硫酸: |
D. 在 在 存在下与氨水反应: 存在下与氨水反应: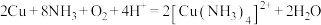 |
您最近半年使用:0次
名校
解题方法
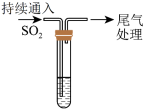
10 . 某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
已知:CuCl为白色固体,难溶于水,能溶于浓盐酸。下列说法不正确的是
| 装置 |
| |
| 序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 1.5mL1mol·L-1CuSO4溶液和3.5mL1mol·L-1NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL1mol·L-1CuCl2溶液和3.5mL1mol·L-1NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
| A.取少量Cu2O固体于试管中,加入5mL0.1mol·L-1NaOH溶液,持续通入SO2,若试管底部有少量紫红色固体,溶液呈绿色,证明实验Ⅰ中砖红色沉淀为Cu2O |
| B.将实验Ⅱ中白色沉淀洗涤干净后,加入浓盐酸,沉淀溶解,然后加入蒸馏水,产生白色沉淀,证明白色沉淀为CuCl |
| C.实验Ⅱ与实验Ⅰ现象不同是因为阴离子不同造成的 |
D.实验Ⅰ、Ⅱ中不一定生成了SO |
您最近半年使用:0次