10-11高一上·浙江绍兴·期中
1 . 取一定量的CuO粉末与0.5 L稀硫酸充分反应后,将一根50 g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24 g, 并收集到224 mL气体(标准状况)。求此CuO粉末的质量____ 。
您最近一年使用:0次
2 . (1)称量一定质量表面含油污的纯铜屑(铜含量为99.84%),置于坩埚中灼烧,将油污充分氧化后除去,直至铜屑表面均呈黑色。冷却后称量,固体质量比灼烧前增加了3.2 %,固体中铜与氧化铜的质量之比为_______。(请将结果化为小数,且保留至小数点后两位)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
您最近一年使用:0次
名校
解题方法
3 . 现有 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到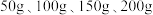 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表:
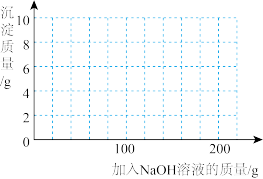
(1) 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为______ g。
(2)试求出混合溶液中 的溶质质量分数是
的溶质质量分数是______ ?(写出计算过程)
(3)混合溶液中 的溶质质量分数为
的溶质质量分数为______ 。
(4)若在 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图______ 。(在答题卡的坐标图中作图)
 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到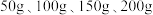 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表: | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
 溶液的质量 溶液的质量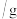 | 50 | 100 | 150 | 200 |
生成沉淀的质量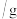 | 0 | 2.45 | 7.35 | 9.8 |
(1)
 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为(2)试求出混合溶液中
 的溶质质量分数是
的溶质质量分数是(3)混合溶液中
 的溶质质量分数为
的溶质质量分数为(4)若在
 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图
您最近一年使用:0次
4 . 将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。求原混合物中单质铁的质量。
您最近一年使用:0次
5 . 铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进行如下实验:
步骤1:在0.750 0 g试样中加入100.00 mL 0.120 0 mol·L-1 KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.100 0 mol·L-1FeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1 g KI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-===2CuI↓+I2。用0.050 00 mol·L-1 Na2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O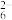 ),消耗14.00 mL。
),消耗14.00 mL。
已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
步骤1:在0.750 0 g试样中加入100.00 mL 0.120 0 mol·L-1 KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.100 0 mol·L-1FeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1 g KI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-===2CuI↓+I2。用0.050 00 mol·L-1 Na2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O
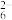 ),消耗14.00 mL。
),消耗14.00 mL。已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
您最近一年使用:0次



