1 . 以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:

已知:砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为_________ 。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_________ 。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是______________ 。
(3)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________ (填化学式)。
(4)某化学兴趣小组要以硫酸锌溶液(含少量硫酸亚铁杂质)制备氧化锌。已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
实验中可选用的试剂:30% H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1 NaOH。实验步骤依次为:_______ ;过滤;_______ ;过滤、洗涤、干燥;900℃煅烧,得到氧化锌。

已知:砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为
NaOH溶液浓度对脱氯率和其他元素浸出率的影响 | ||||
NaOH浓度/mol•L-1 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
(4)某化学兴趣小组要以硫酸锌溶液(含少量硫酸亚铁杂质)制备氧化锌。已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
您最近一年使用:0次
2 . 从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
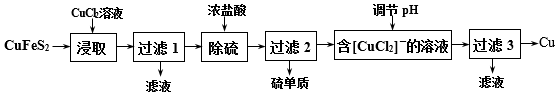
(1)“浸取”时,将黄铜矿进行粉碎的目的是___ 。
(2)“浸取”时,反应生成CuCl、FeCl2和S,该反应化学方程式为____ 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是____ 。
(4)“过滤3”所得滤液中可以循环使用的物质有___ 和____ ;为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为___ mol。
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2,此工艺与上述工艺相比,主要缺点有
2Cu+SO2,此工艺与上述工艺相比,主要缺点有_____ 。

(1)“浸取”时,将黄铜矿进行粉碎的目的是
(2)“浸取”时,反应生成CuCl、FeCl2和S,该反应化学方程式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)“过滤3”所得滤液中可以循环使用的物质有
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2
 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2,此工艺与上述工艺相比,主要缺点有
2Cu+SO2,此工艺与上述工艺相比,主要缺点有
您最近一年使用:0次
3 . 已知A~K均为中学化学中常见的物质,它们之间有如图所示的转化关系,其中A为两种物质组成的混合物,H、I、K为单质,H是气体,G是红褐色沉淀。(反应过程中生成的水及其他产物没有列出)
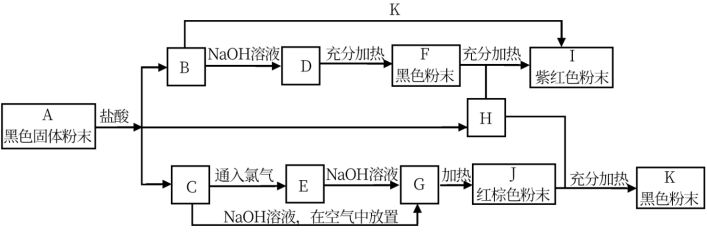
请回答以下问题:
(1)写出下列物质的化学式: H_______ ,J_______ 。
(2)写出A跟盐酸反应生成B的化学方程式:_______ 。
(3)写出C跟氯气反应生成E的化学方程式:._______ 。

请回答以下问题:
(1)写出下列物质的化学式: H
(2)写出A跟盐酸反应生成B的化学方程式:
(3)写出C跟氯气反应生成E的化学方程式:.
您最近一年使用:0次
4 . 某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
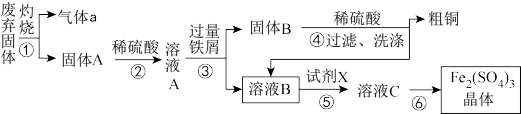
已知:铁屑能将Fe3+还原为Fe2+。
(1)Cu2S中Cu元素的化合价为_______ ,①中涉及的反应有:Cu2S+O2 2Cu+SO2,该反应的氧化剂是
2Cu+SO2,该反应的氧化剂是_______ 。
(2)③的实验操作中用到的玻璃仪器有_______ 。
(3)①试剂X通常选择H2O2,在反应中用作_______ (填氧化剂或还原剂)。
②试剂X若用Cl2,缺点是_______ 。(写出两个)
(4)灼烧过程中会有少量Cu2O生成,已知Cu2O与稀硫酸反应,得到蓝色溶液和红色固体单质,有关离子方程式为_______ 。

已知:铁屑能将Fe3+还原为Fe2+。
(1)Cu2S中Cu元素的化合价为
 2Cu+SO2,该反应的氧化剂是
2Cu+SO2,该反应的氧化剂是(2)③的实验操作中用到的玻璃仪器有
(3)①试剂X通常选择H2O2,在反应中用作
②试剂X若用Cl2,缺点是
(4)灼烧过程中会有少量Cu2O生成,已知Cu2O与稀硫酸反应,得到蓝色溶液和红色固体单质,有关离子方程式为
您最近一年使用:0次
5 . 碱式氯化铜(不溶于水的绿色晶体)是一种农药,分子式:CuCl2·3Cu(OH)2·XH2O(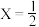 ,1,2).为验证其组成并确定X值,某学生设计了以下几步实验:
,1,2).为验证其组成并确定X值,某学生设计了以下几步实验:
①取a g的晶体研成粉末
②晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g
③另取a g的晶体,溶于足量稀硝酸中充分溶解得到溶液
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有_______ (填序号)。
(2)步骤②中晶体应放在_______ (填仪器名称)中灼烧。
(3)步骤④主要包括:加入足量硝酸银溶液→_______ →_______ →晾干→称量。
(4)碱式氯化铜的摩尔质量为_______ (用含a、c的代数式表示。)
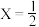 ,1,2).为验证其组成并确定X值,某学生设计了以下几步实验:
,1,2).为验证其组成并确定X值,某学生设计了以下几步实验:①取a g的晶体研成粉末
②晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g
③另取a g的晶体,溶于足量稀硝酸中充分溶解得到溶液
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有
(2)步骤②中晶体应放在
(3)步骤④主要包括:加入足量硝酸银溶液→
(4)碱式氯化铜的摩尔质量为
您最近一年使用:0次
6 . 某工业废渣中主要含有Cu2O及少量杂质(Al2O3、Fe2O3、SiO2等),从该工业废渣中提取铜的工艺流程如图所示[已知Al3+与足量NaOH溶液反应生成NaAlO2,最终不会有Al(OH)3沉淀]:
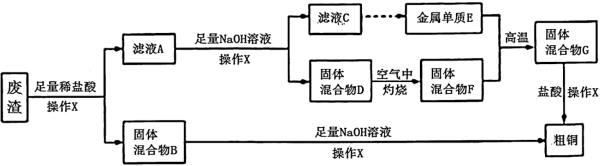
试回答下列问题。
(1)滤液A中的金属阳离子为Cu2+、Al3+、_______ ,固体混合物D中含有的物质是_______ (写化学式)。
(2)操作X为常见的实验操作,其操作名称是_______ ,在实验室,该操作中使用的玻璃仪器有_______ 。
(3)上述方法制备的铜可用来制备铜合金,某铜合金中可能含有Mg、Zn中的一种,采用下列方法可测定该铜合金的组成。
实验方法:
取10.0g铜合金粉末样品放入烧杯中,将56.0g 14.0%的稀硫酸(密度为1.092g∙cm-3)平均分四次依次加入该烧杯中,每次均充分反应。
实验数据记录如下表:
①稀硫酸的物质的量浓度为_______ mol•L-1 。(结果保留两位小数)
②该铜合金中另一种金属是_______ (填化学式)。
③该铜合金中铜的质量分数为_______ 。

试回答下列问题。
(1)滤液A中的金属阳离子为Cu2+、Al3+、
(2)操作X为常见的实验操作,其操作名称是
(3)上述方法制备的铜可用来制备铜合金,某铜合金中可能含有Mg、Zn中的一种,采用下列方法可测定该铜合金的组成。
实验方法:
取10.0g铜合金粉末样品放入烧杯中,将56.0g 14.0%的稀硫酸(密度为1.092g∙cm-3)平均分四次依次加入该烧杯中,每次均充分反应。
实验数据记录如下表:
实验编号 | a | b | c | d |
加入稀硫酸的质量/g | 14.0 | 14.0 | 14.0 | 14.0 |
剩余固体的质量/g | 8.7 | 7.4 | 6.1 | 6.0 |
①稀硫酸的物质的量浓度为
②该铜合金中另一种金属是
③该铜合金中铜的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 从铬铜废催化剂(主要含CuO·Cr2O3、少量有机物及水)中回收铬和铜的实验流程如下:
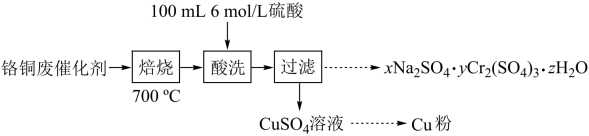
(1)700℃“焙烧”可使Cr2O3不溶于酸,焙烧的另一目的是_______
(2)配制“酸洗”所用100mL6mol·L-1硫酸需要的玻璃仪器有:量筒、烧杯、100mL容量瓶、_______ 和_______ ;为使研碎的烧渣中CuO充分溶解,应采取的措施是_______
(3)为确定xNa2SO4·yCr2(SO4)3·zH2O的组成,进行下列实验:
①称取样品1.9320g溶于水,加入足量盐酸酸化的BaCl2溶液,得到1.8640g沉淀。
②另称取样品1.9320g溶于水,经H2O2在碱性条件下氧化、煮沸、酸化得Na2Cr2O7和Na2SO4的混合酸性溶液;加入稍过量的KI溶液( +6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
+6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
根据上述实验数据,确定xNa2SO4·yCr2(SO4)3·zH2O的化学式(写出计算过程)___________ 。

(1)700℃“焙烧”可使Cr2O3不溶于酸,焙烧的另一目的是
(2)配制“酸洗”所用100mL6mol·L-1硫酸需要的玻璃仪器有:量筒、烧杯、100mL容量瓶、
(3)为确定xNa2SO4·yCr2(SO4)3·zH2O的组成,进行下列实验:
①称取样品1.9320g溶于水,加入足量盐酸酸化的BaCl2溶液,得到1.8640g沉淀。
②另称取样品1.9320g溶于水,经H2O2在碱性条件下氧化、煮沸、酸化得Na2Cr2O7和Na2SO4的混合酸性溶液;加入稍过量的KI溶液(
 +6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
+6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。根据上述实验数据,确定xNa2SO4·yCr2(SO4)3·zH2O的化学式(写出计算过程)
您最近一年使用:0次
8 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
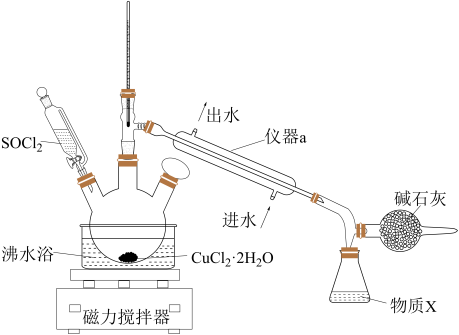
已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑
(1)仪器a的名称是______ ,锥形瓶中得到的物质X的化学式为______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是______ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2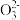 =S4
=S4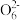 +2I-)。
+2I-)。
①滴定到终点时的现象是______ 。
②该试样中铜元素的百分含量为______ 。

已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2
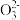 =S4
=S4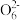 +2I-)。
+2I-)。①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近一年使用:0次
2020-12-30更新
|
187次组卷
|
3卷引用:江苏省海安高级中学2020-2021学年高二上学期高中合格性考试化学试题
名校
9 . 氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。写出该反应的离子方程式____________________________ 。
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000 g样品,放入盛有20 mL过量FeCl3 溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50 mL;
c.立即用0.2000 mol/LCe(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积;
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00 mL。已知:CuC1+Fe3+=Cu2++Fe2++Cl-、 Fe2++Ce4+=Fe3++Ce3+
①配制100 mL 0.2000 mol/L的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要______________ 。
②进行步骤c时若操作缓慢,则测得CuCl的纯度________ (填“偏大”、“偏小”或“无影响”)。
③通过计算确定该样品中CuCl的纯度_____________ (写出计算过程)。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。写出该反应的离子方程式
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000 g样品,放入盛有20 mL过量FeCl3 溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50 mL;
c.立即用0.2000 mol/LCe(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积;
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00 mL。已知:CuC1+Fe3+=Cu2++Fe2++Cl-、 Fe2++Ce4+=Fe3++Ce3+
①配制100 mL 0.2000 mol/L的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要
②进行步骤c时若操作缓慢,则测得CuCl的纯度
③通过计算确定该样品中CuCl的纯度
您最近一年使用:0次
名校
解题方法
10 . 实验室利用下列实验装置来测定铜的氧化物CuXO的组成。
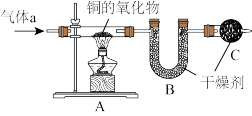
(1)若气体a为纯净的氢气,在点燃A装置中酒精灯以前,要将氢气通过整个装置一段时间,其目的是__ 。
(2)若气体a为纯净的氢气,当铜的氧化物CuXO完全被还原为Cu时,称得Cu的质量为6.4g,同时称得B装置的质量增加了0.9克,则这种铜的氧化物中铜元素和氧元素的原子个数之比的原始计算式为_____ ,该铜的氧化物的化学式为____ 。
(3)若气体a为混有少量H2O(g)的氢气,而又未经干燥处理直接通至装置A中,当铜的氧化物CuXO完全被还原为Cu时,仍然利用称量Cu的质量和B装置增加的质量的方法来完成这个实验,将使测定结果中铜元素与氧元素质量之比的值(选填“偏大”、“偏小”或“不受影响”)_____ 。
(4)若气体a为混有少量H2O(g)的氢气,不增加任何其他实验装置也不改动上述装置的连接顺序,仍用其来测定CuXO的组成,必须测得哪些数据才能得到x的值?___

(1)若气体a为纯净的氢气,在点燃A装置中酒精灯以前,要将氢气通过整个装置一段时间,其目的是
(2)若气体a为纯净的氢气,当铜的氧化物CuXO完全被还原为Cu时,称得Cu的质量为6.4g,同时称得B装置的质量增加了0.9克,则这种铜的氧化物中铜元素和氧元素的原子个数之比的原始计算式为
(3)若气体a为混有少量H2O(g)的氢气,而又未经干燥处理直接通至装置A中,当铜的氧化物CuXO完全被还原为Cu时,仍然利用称量Cu的质量和B装置增加的质量的方法来完成这个实验,将使测定结果中铜元素与氧元素质量之比的值(选填“偏大”、“偏小”或“不受影响”)
(4)若气体a为混有少量H2O(g)的氢气,不增加任何其他实验装置也不改动上述装置的连接顺序,仍用其来测定CuXO的组成,必须测得哪些数据才能得到x的值?
您最近一年使用:0次



