解题方法
1 . 淡黄色粉末物质A有以下转化关系:
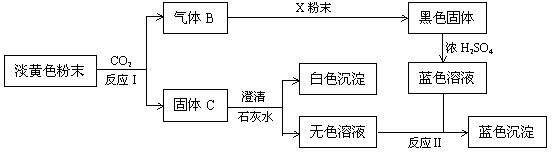
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是___________ , X粉末是___________ 。
(2)写出反应Ⅰ的化学方程式____________________________________________ 。
(3)写出反应Ⅱ的离子方程式____________________________________________ 。

根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是
(2)写出反应Ⅰ的化学方程式
(3)写出反应Ⅱ的离子方程式
您最近一年使用:0次
名校
2 . 溴化亚铜可用作工业催化剂,是一种白色粉末,微溶于冷水,不溶于乙醇等有机溶剂,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去水中的________________ (写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为__________________ ;
②控制反应在60℃进行,实验中可采取的措施是____________________ ;
③说明反应已完成的现象是_____________________ 。
(3)步骤2过滤需要避光的原因是_____________________ 。
(4)步骤3中洗涤剂需“溶有SO2”的原因是____________________ 。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。
请补充实验步骤[须用到SO2(贮存在钢瓶中)、20%NaOH溶液]:
①_________________ 。
②___________________ 。
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去水中的
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为
②控制反应在60℃进行,实验中可采取的措施是
③说明反应已完成的现象是
(3)步骤2过滤需要避光的原因是
(4)步骤3中洗涤剂需“溶有SO2”的原因是
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。
请补充实验步骤[须用到SO2(贮存在钢瓶中)、20%NaOH溶液]:
①
②
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。
您最近一年使用:0次
2017-11-27更新
|
561次组卷
|
3卷引用:江苏省泰州中学2018届高三上学期期中考试化学试题
解题方法
3 . Cu2O是一种几乎不溶于水的氧化物,在涂料、玻璃等领域应用非常广泛。一种以硫化铜矿石(含CuFeS2、Cu2S 等) 为原料制取Cu2O 的工艺流程如下:

(1)“硫酸化焙烧”时:①硫化铜矿需粉碎的目的是_________ ;②CuS 与O2反应生成CuSO4等物质的化学方程式为________ ;③加入Na2SO4的作用除减小物料间黏结外,另一主要作用是__________ 。
(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制_________ (至少列举两点)。
(3)“制备”时,溶液的pH与Cu2O 的产率关系如右图所示。
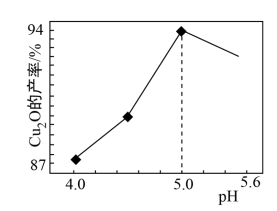
①在100℃时,发生反应的离子方程式为__________
②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为________ 。

(1)“硫酸化焙烧”时:①硫化铜矿需粉碎的目的是
(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制
(3)“制备”时,溶液的pH与Cu2O 的产率关系如右图所示。

①在100℃时,发生反应的离子方程式为
②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为
您最近一年使用:0次
4 . A~J是中学化学中常见的化学物质,它们之间的相互转化关系如下列框图所示(部分反应的产物未列出)。

已知:A、F为无色气体单质,B为无色具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质。请回答下列问题:
(1)D的化学式为_____________ ;F的电子式为______________ 。
(2)B和C反应的化学方程式为_______________ 。该反应中生成1molF时,转移的电子数为_________ mol
(3)E与G的稀溶液反应的离子方程式为:____________________ 。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式___________________ 。

已知:A、F为无色气体单质,B为无色具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质。请回答下列问题:
(1)D的化学式为
(2)B和C反应的化学方程式为
(3)E与G的稀溶液反应的离子方程式为:
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式
您最近一年使用:0次
解题方法
5 . 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
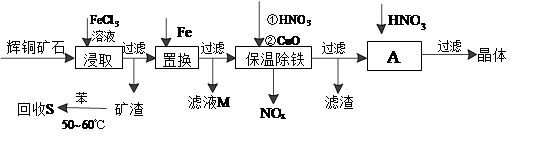
(1)写出浸取过程中Cu2S溶解的离子方程式____________ 。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是_________ 、__________ 。
(3)保温除铁过程中加入CuO的目的是____________ 。
(4)A步操作为____________ 要用硝酸调节溶液的pH,其理由是____________ 。

(1)写出浸取过程中Cu2S溶解的离子方程式
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是
(3)保温除铁过程中加入CuO的目的是
(4)A步操作为
您最近一年使用:0次
名校
解题方法
6 . 在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质。C为一种黑色粉末,D为一种气体。
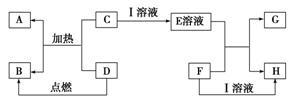
请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀,则A为_________________ ;D可能为__________________ 。
(2)若G为蓝色沉淀,H为难溶性盐,则I为_________________ 。
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为______________ ;F可能为_____________ 。

请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀,则A为
(2)若G为蓝色沉淀,H为难溶性盐,则I为
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为
您最近一年使用:0次
2016-12-09更新
|
387次组卷
|
2卷引用:江苏省扬州中学2020-2021学年高一上学期开学考暨奥赛选拔化学试题
2012·江苏·二模
解题方法
7 . 碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3,某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L-1的Cu(NO3)2溶液、2.0mL 0.50 mol·L-1的NaOH溶液和0.25 mol·L-1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
①实验室制取少许孔雀石,应该采用的条件是___________ 。
②80℃时,所制得的孔雀石有少量褐色物质的原因是___________ 。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
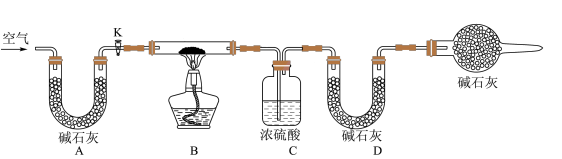
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:___________ 。
步骤5:称量相关装置的质量。
①装置A的作用是___________ ;若无装置E,则实验测定的x/y的值将___________ (选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的___________ (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式___________ 。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3,某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L-1的Cu(NO3)2溶液、2.0mL 0.50 mol·L-1的NaOH溶液和0.25 mol·L-1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
| 编号 | V (Na2CO3)/ mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) | |
表Ⅰ | 表Ⅱ | |||||
②80℃时,所制得的孔雀石有少量褐色物质的原因是
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:
步骤5:称量相关装置的质量。
①装置A的作用是
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的
您最近一年使用:0次
2011·江苏南京·模拟预测
8 . 由黄铜矿为原料(主要成分为CuFeS2)制备99.95%~99.98%精铜的流程如下:

(1)高温焙烧第一反应为2CuFeS2+4O2=Cu2S+2FeO+3SO2,该反应中氧化剂为____________ 。产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2=2Cu2O+2SO2,2Cu2O+Cu2S=6Cu+SO2。6mol CuFeS2和14.25mol O2反应,理论上可得到Cu________ mol(假定各步反应都完全)。
(2)取三份质量均为16.9g的上述粗铜,成分为Cu、Fe、Zn。现在需要分析其中铜的含量,进行如下实验(所有气体体积均为标况下的数据):
① 取一份粗铜放入足量稀硫酸中,共放出氢气1.568L。
② 另取一份粗铜放入稍过量的较浓硝酸中,加热使合金铜完全溶解,收集到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
③ 再取一份粗铜进行电解精炼,阳极完全溶解后阴极增加质量17.28g。
求粗铜中Cu的质量分数_________ (保留一位小数)。

(1)高温焙烧第一反应为2CuFeS2+4O2=Cu2S+2FeO+3SO2,该反应中氧化剂为
(2)取三份质量均为16.9g的上述粗铜,成分为Cu、Fe、Zn。现在需要分析其中铜的含量,进行如下实验(所有气体体积均为标况下的数据):
① 取一份粗铜放入足量稀硫酸中,共放出氢气1.568L。
② 另取一份粗铜放入稍过量的较浓硝酸中,加热使合金铜完全溶解,收集到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
③ 再取一份粗铜进行电解精炼,阳极完全溶解后阴极增加质量17.28g。
求粗铜中Cu的质量分数
您最近一年使用:0次
10-11高三上·江苏南京·阶段练习
9 . 硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_________ ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是___________ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式______________________ 。
(2)测定硫酸铜晶体中结晶水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5:_________________ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。现取25.0g CuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为________________ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为_______________ 。(填字母)
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式
(2)测定硫酸铜晶体中结晶水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5:
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。现取25.0g CuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为
| A.0 mol | B.0.1mol | C.0.125mol | D.大于0.125mol |
您最近一年使用:0次
2010高三·江苏南通·专题练习
10 . 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:
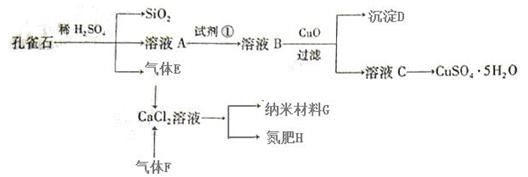
已知:
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲ (填化学式)。写出该反应的化学方程式 ▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲ (填名称);滴定达到终点的现象为 ▲ 。

已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲ (填化学式)。写出该反应的化学方程式 ▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲ (填名称);滴定达到终点的现象为 ▲ 。
您最近一年使用:0次



