解题方法
1 . 某小组同学探究铜和浓硝酸的反应,进行如下实验:
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
(1)写出铜和浓硝酸反应的离子反应方程式:______ 。
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:______ 。
(3)取⑤中溶液,______ (填操作和现象),证实猜想2成立。
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
结合上述实验现象,下列推测合理的是______ (填字母序号)。
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O HNO3+HNO2(慢)
HNO3+HNO2(慢)
反应2:2HNO2 NO2+NO+H2O(快)
NO2+NO+H2O(快)
解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因______ 。
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
①实验中加入的固体物质可能是______ (写出一种,填化学式)。
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,______ ,______ 。
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:
(3)取⑤中溶液,
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
| 通入气体 | 氮气 | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,25min后溶液变为蓝色 | 液面上方出现明显的红棕色气体,5min后溶液变为蓝色 |
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O
 HNO3+HNO2(慢)
HNO3+HNO2(慢)反应2:2HNO2
 NO2+NO+H2O(快)
NO2+NO+H2O(快)解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
| 加入物质 | ______固体 | 3滴30%H2O2溶液 | 3滴水 |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,
您最近一年使用:0次
2 . 用如图方法回收废旧CPU中的单质Au(金),Ag和Cu。
(1)酸溶后经_______ 操作,将混合物分离。
(2)浓、稀 均可作酸溶试剂。溶解等量的Cu消耗
均可作酸溶试剂。溶解等量的Cu消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:_______ 。
(3)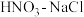 与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_________________ 。

②关于溶金的下列说法正确的是_______ 。
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是____ mol。

(1)酸溶后经
(2)浓、稀
 均可作酸溶试剂。溶解等量的Cu消耗
均可作酸溶试剂。溶解等量的Cu消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(3)
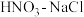 与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是
您最近一年使用:0次
2022-05-27更新
|
340次组卷
|
3卷引用:北京市第一六一中学2021-2022学年高一下学期期中阶段(选考班)化学试题
名校
解题方法
3 . 某实验小组在研究硝酸与铜的反应时,发现稀硝酸和铜反应后的混合液为蓝色,而浓硝酸和铜反应后的混合液为绿色,为此对产生绿色的原因开展探究。按要求完成下列问题:
[猜想假设]
(1)假设1:___________
假设2:硝酸铜溶液中溶解了
[实验操作及现象分析]
实验一:向蒸馏水中不断加入硝酸铜晶体,最终配成饱和溶液。配制过程中溶液颜色始终是蓝色,未见绿色出现。
甲同学根据实验一的现象证明了假设1不成立,请补全假设。
实验二:
(2)甲同学在实验一的基础上继续开展了实验二,并初步验证了假设2成立,他的实验操作及现象是___________ 。
乙同学认为假设2不严谨,用以下实验对假设2进行了深入探究:
实验三:
(3)结合实验三,乙同学认为假设2不严谨的证据是___________
(4)乙同学查阅资料发现:
①铜与浓硝酸反应后溶液呈现绿色是由于 (或
(或 )与铜离子作用的结果。
)与铜离子作用的结果。
②金属和浓 的反应一旦发生后速率不断加快。原因是过程中有
的反应一旦发生后速率不断加快。原因是过程中有 生成。如
生成。如 和浓
和浓 反应,开始生成的
反应,开始生成的 溶于水形成
溶于水形成 ,它再和
,它再和 反应,速率就大大加快。
反应,速率就大大加快。
请依据资料完成以下离子反应方程式。
i.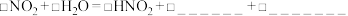 ;
;___________
ii. ;
;___________
iii.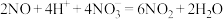
实验四:乙同学通过以下实验证实了反应过程中 的生成。
的生成。
(5)结合化学用语,解释实验3产生该现象的原因是___________ 。
[猜想假设]
(1)假设1:
假设2:硝酸铜溶液中溶解了

[实验操作及现象分析]
实验一:向蒸馏水中不断加入硝酸铜晶体,最终配成饱和溶液。配制过程中溶液颜色始终是蓝色,未见绿色出现。
甲同学根据实验一的现象证明了假设1不成立,请补全假设。
实验二:
(2)甲同学在实验一的基础上继续开展了实验二,并初步验证了假设2成立,他的实验操作及现象是
乙同学认为假设2不严谨,用以下实验对假设2进行了深入探究:
实验三:
| 操作及试剂 | 现象 |
向浓硝酸和铜反应后的混合液中通入 | 大量红棕色气体放出,短时间内溶液仍保持绿色。长时间后变成蓝色 |
(4)乙同学查阅资料发现:
①铜与浓硝酸反应后溶液呈现绿色是由于
 (或
(或 )与铜离子作用的结果。
)与铜离子作用的结果。②金属和浓
 的反应一旦发生后速率不断加快。原因是过程中有
的反应一旦发生后速率不断加快。原因是过程中有 生成。如
生成。如 和浓
和浓 反应,开始生成的
反应,开始生成的 溶于水形成
溶于水形成 ,它再和
,它再和 反应,速率就大大加快。
反应,速率就大大加快。请依据资料完成以下离子反应方程式。
i.
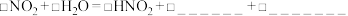 ;
;ii.
 ;
;iii.
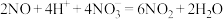
实验四:乙同学通过以下实验证实了反应过程中
 的生成。
的生成。| 实验 | 操作 | 现象 |
| 1 | 向试管a中加入lmL浓硝酸,再插入铜丝 | 快速产生红棕色气体,溶液变为绿色 |
| 2 | 向试管b中加入1mL浓硝酸,3滴蒸馏水,再插入铜丝 | 快速产生红棕色气体溶液变为绿色 |
| 3 | 向试管c中加入1mL浓硝酸,3滴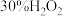 ,再插入铜丝 ,再插入铜丝 | 反应较慢,溶液变为蓝色 |
您最近一年使用:0次
2022-03-31更新
|
702次组卷
|
3卷引用:北京市房山区2022届高三一模化学试题
解题方法
4 . 某校课外活动小组为了探讨铜与硝酸的反应设计了如下实验。
(1)甲同学欲探究铜与稀硝酸反应产生的气体主要是NO,设计装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是含有一半空气的注射器。
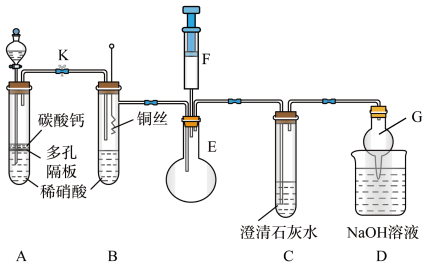
请回答有关问题:
①装置A中进行反应时打开止水夹K,当装置C中_________ 时,关闭止水夹K,试分析这样操作的目的是________ ,A中反应的离子方程式为______________ 。
②在完成①中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是__________________ ,B中反应的离子方程式为____________________ 。
③为进一步证明产物是NO,将注射器F中的空气推入E中,看到的现象是_________________ 。
④装置G的作用是_____________________ 。
(2)同学们发现铜与稀、浓硝酸反应所得溶液的颜色不同,并记录如下:
有同学认为是铜与浓硝酸反应的溶液中溶解了生成的气体,也有同学认为是溶液中剩余硝酸浓度较大所致,同学们分别设计了以下4个实验来判断该看法是否正确,以下方案中可行的是(选填序号字母)____________ 。
a. 向上述绿色溶液中通入氮气,观察颜色变化
b. 加水稀释上述绿色溶液,观察颜色变化
c. 向饱和的硝酸铜溶液中不断滴加14 mol·L-1HNO3溶液
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
(1)甲同学欲探究铜与稀硝酸反应产生的气体主要是NO,设计装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是含有一半空气的注射器。

请回答有关问题:
①装置A中进行反应时打开止水夹K,当装置C中
②在完成①中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是
③为进一步证明产物是NO,将注射器F中的空气推入E中,看到的现象是
④装置G的作用是
(2)同学们发现铜与稀、浓硝酸反应所得溶液的颜色不同,并记录如下:
| 将1 g细铜丝放入盛有10 mL的1 mol·L-1 HNO3溶液的试管中加热 | 铜丝表面有无色气体逸出,溶液变为天蓝色 |
| 将1 g细铜丝放入盛有10 mL的14 mol·L-1HNO3溶液的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色 |
a. 向上述绿色溶液中通入氮气,观察颜色变化
b. 加水稀释上述绿色溶液,观察颜色变化
c. 向饱和的硝酸铜溶液中不断滴加14 mol·L-1HNO3溶液
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
您最近一年使用:0次
2010·北京·二模
解题方法
5 . 硫酸铜、硝酸铁都是重要的化工原料。
(1)以下是某工厂用含铁的废铜为原料生产胆巩(CuSO4·5H2O)的生产流程示意图:
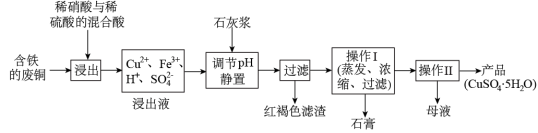
胆矾和石膏在不同温度下的溶解度(∥100g水)见下表。
请回答下列问题:
①红褐色滤渣的主要成分是
②写出浸出过程中生成硫酸铜的化学方程式 ;
③操作I的温度应该控制在 左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液 、 、洗涤、干燥。
(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3(固定所用
仪器和加热装置未画出)。
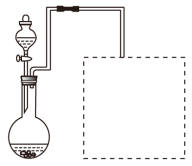
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内。该实验中对圆底烧瓶加热的最佳方式是 加热;
②请在图中虚线框内画出尾气吸收装置(提示:碱液可快速、充分吸收产生的氮氧化物气体)。
(1)以下是某工厂用含铁的废铜为原料生产胆巩(CuSO4·5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(∥100g水)见下表。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
①红褐色滤渣的主要成分是
②写出浸出过程中生成硫酸铜的化学方程式 ;
③操作I的温度应该控制在 左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液 、 、洗涤、干燥。
(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3(固定所用
仪器和加热装置未画出)。

①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内。该实验中对圆底烧瓶加热的最佳方式是 加热;
②请在图中虚线框内画出尾气吸收装置(提示:碱液可快速、充分吸收产生的氮氧化物气体)。
您最近一年使用:0次



