名校
解题方法
1 . 将足量SO2通入AgNO3溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热,夹持等装置略)。
资料:i.Ag2SO4微溶于水;Ag2SO3难溶于水。
ii.Ag2SO4、Ag2SO3均溶于氨水。___________ 。
②B的作用是___________ 。
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
推测白色沉淀(t1)可能为Ag2SO4、Ag2SO3或混合物。探究如下:
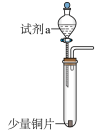
①试剂a是___________ 。
②产生白色沉淀Y的原因是___________ 。
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤,洗涤。向洗净的沉淀中加入浓HNO3,证实沉淀含Ag。现象是___________ 。
(4)通过检测 探究产生Ag的原因。
探究产生Ag的原因。
①实验:___________ 。(用化学方程式表示)
②t1时,C中产生白色沉淀的离子方程式是___________ 。
综上可知,化学反应的产物与反应速率有关。
资料:i.Ag2SO4微溶于水;Ag2SO3难溶于水。
ii.Ag2SO4、Ag2SO3均溶于氨水。
②B的作用是
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
| 时间 | 反应开始时(t1) | 一段时间后(t2) | 较长时间后(t3) |
| 颜色 | 白色 | 灰黑色 | 灰黑色加深 |

①试剂a是
②产生白色沉淀Y的原因是
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤,洗涤。向洗净的沉淀中加入浓HNO3,证实沉淀含Ag。现象是
(4)通过检测
 探究产生Ag的原因。
探究产生Ag的原因。①实验:
 (已排除O2的影响)
(已排除O2的影响)
②t1时,C中产生白色沉淀的离子方程式是
综上可知,化学反应的产物与反应速率有关。
您最近半年使用:0次
名校
2 . 下列不符合 环境保护和绿色化学理念的是
| A.用铜和浓硝酸反应制取Cu(NO3)2 |
B.在催化剂,400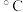 左右用NH3 与NO反应生成N2和H2O 左右用NH3 与NO反应生成N2和H2O |
| C.用银作催化剂,乙烯和氧气反应制取环氧乙烷,原子利用率100% |
| D.制CuSO4时先将Cu氧化成CuO后再与稀硫酸反应 |
您最近半年使用:0次
名校
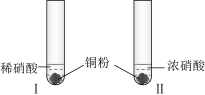
3 . 某学习小组探究稀HNO3、浓HNO3与铜的反应。
(1)试管I中Cu与稀HNO3反应的离子方程式是_______ 。
(2)II中反应的速率比I中的快,原因是_______ 。
(3)针对II中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取II中绿色溶液,分为两等份。
①取一份加入如图所示装置中,_______ (填“操作”和“现象”),证实II中溶解了NO2。_______ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1:HNO3;浓度越稀,溶液中 的数目越少,被还原时,每个
的数目越少,被还原时,每个 从还原剂处获得较多电子的机会
从还原剂处获得较多电子的机会_______ (填“增多”或“减少”),因此被还原为更低价态。
解释2:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
实验验证浓硝酸能将NO氧化成NO2,实验装置如下图:_______ 。
②C中盛放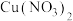 和
和_______ 。
③该小组证实推测的合理性所依据的实验现象是_______ 。
装置(尾气处理装置略) | 现象 |
| I中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
| II中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管I中Cu与稀HNO3反应的离子方程式是
(2)II中反应的速率比I中的快,原因是
(3)针对II中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取II中绿色溶液,分为两等份。
①取一份加入如图所示装置中,

(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1:HNO3;浓度越稀,溶液中
 的数目越少,被还原时,每个
的数目越少,被还原时,每个 从还原剂处获得较多电子的机会
从还原剂处获得较多电子的机会解释2:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
实验验证浓硝酸能将NO氧化成NO2,实验装置如下图:
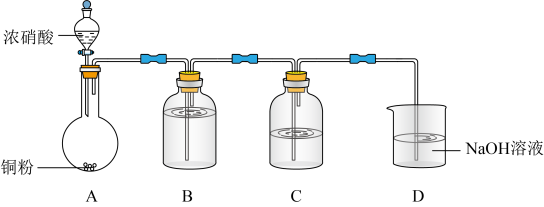
②C中盛放
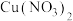 和
和③该小组证实推测的合理性所依据的实验现象是
您最近半年使用:0次
名校
解题方法
4 . 研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ产生红棕色气体的离子方程式是___________ 。实验Ⅱ产生红棕色气体的化学方程式是___________ 。
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色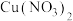 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是___________ ,滴加少量蓝色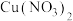 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
| 装置 | 编号 | 试剂a | 现象 |
| Ⅰ | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体。 |
| Ⅱ | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色。 |
(1)实验Ⅰ产生红棕色气体的离子方程式是
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色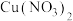 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是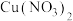 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

 的证据是
的证据是Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近半年使用:0次
名校
解题方法
5 . 铜与硝酸反应的装置如图所示,实验步骤如下:
步骤2:一段时间后,试管a中反应变平缓,溶液逐渐变成蓝色,同时气体颜色从下方开始变浅,最终变成无色。
步骤3:反应停止后,用注射器向试管a中注入少量稀硫酸,铜丝继续溶解,产生无色气体。
下列说法不正确的是

步骤2:一段时间后,试管a中反应变平缓,溶液逐渐变成蓝色,同时气体颜色从下方开始变浅,最终变成无色。
步骤3:反应停止后,用注射器向试管a中注入少量稀硫酸,铜丝继续溶解,产生无色气体。
下列说法不正确的是
| A.步骤1观察到试管a中充满红棕色气体,说明铜和浓硝酸反应生成NO2 |
| B.步骤2观察到反应变平缓而且气体颜色从下方开始变浅,说明浓硝酸已经变成稀硝酸 |
| C.步骤3固体继续溶解,说明此时铜被硫酸氧化 |
| D.相对于步骤2,步骤1中溶液显绿色可能是NO2溶解在硝酸铜中所致 |
您最近半年使用:0次
2024-04-28更新
|
71次组卷
|
2卷引用:北师大附属实验中学2023-2024学年度第二学期期中试卷
名校
解题方法
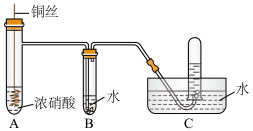
6 . 某同学用稀硝酸和铜反应制NO,发现化学反应速率较慢,因此改用浓硝酸按下图所示装置制取NO。_______ 。
(2)Cu与浓硝酸反应的化学方程式是_______ ,其中硝酸体现酸性和_______ 性。
(3)B中反应的化学方程式是_______ 。
(4)某同学做如下实验,以检验反应中的能量变化。_______ 热反应;(b)中温度降低,由此可以判断(b)中反应是_______ 热反应。
②写出铝与盐酸反应的离子方程式:_______ 。
③根据能量守恒定律,(b)中反应物的总能量应该_______ (填“低于”或“高于”)生成物的总能量。
(2)Cu与浓硝酸反应的化学方程式是
(3)B中反应的化学方程式是
(4)某同学做如下实验,以检验反应中的能量变化。

②写出铝与盐酸反应的离子方程式:
③根据能量守恒定律,(b)中反应物的总能量应该
您最近半年使用:0次
名校
7 . 下列解释实验事实的方程式不正确的是
A.氨气遇浓盐酸产生白烟: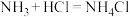 |
B.铁粉与水蒸气在高温条件下反应: |
C.浓硫酸与木炭加热产生气体: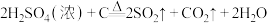 |
D.向铜粉中滴加稀HNO3,产生气体: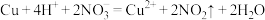 |
您最近半年使用:0次
2024-04-08更新
|
314次组卷
|
3卷引用:北京市中关村中学2023-2024学年高一下学期开学考化学试题
名校
8 . 下列实验室制取气体的方法不合理的是
| A.锌粒与稀硫酸反应制H2 | B.加热浓氨水制NH3 |
| C.铜与浓硝酸反应制NO | D.二氧化锰与浓盐酸共热制Cl2 |
您最近半年使用:0次
2024-04-08更新
|
41次组卷
|
2卷引用:北京市第八十中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
9 . 某小组探究铜粉与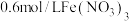 溶液(其中
溶液(其中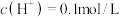 )反应可能的化学过程。
)反应可能的化学过程。
【预测】
(1)甲同学认为该体系只发生 氧化Cu单质的反应,离子方程式为
氧化Cu单质的反应,离子方程式为_______ 。
(2)乙同学认为该体系只发生 在酸性条件(
在酸性条件(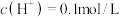 )下氧化Cu单质的反应,离子方程式为
)下氧化Cu单质的反应,离子方程式为________ 。
丙同学认为该体系为 、
、 [
[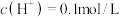 ]共同与Cu参与反应过程。
]共同与Cu参与反应过程。
【验证】
【分析】
(3)丙同学分析上述三个实验现象认为 参与反应,其实验证据是
参与反应,其实验证据是________ 。经实验测定 浓度降低,证实
浓度降低,证实 参与反应过程。
参与反应过程。
(4)进一步寻找实验iii反应后溶液呈深棕色的原因,丙同学查阅资料得知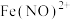 呈棕色,
呈棕色,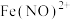 会缓慢分解
会缓慢分解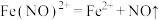 ,推测深棕色产生的反应离子方程式为
,推测深棕色产生的反应离子方程式为______ , ______
______ _______+______。
_______+______。
【结论】
Cu与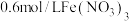 溶液体系首先发生
溶液体系首先发生 氧化Cu的过程,产生
氧化Cu的过程,产生 ,然后
,然后 氧化体系中的
氧化体系中的 ,
, 的还原产物主要以
的还原产物主要以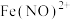 形式存在。
形式存在。
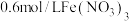 溶液(其中
溶液(其中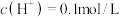 )反应可能的化学过程。
)反应可能的化学过程。【预测】
(1)甲同学认为该体系只发生
 氧化Cu单质的反应,离子方程式为
氧化Cu单质的反应,离子方程式为(2)乙同学认为该体系只发生
 在酸性条件(
在酸性条件(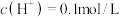 )下氧化Cu单质的反应,离子方程式为
)下氧化Cu单质的反应,离子方程式为丙同学认为该体系为
 、
、 [
[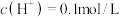 ]共同与Cu参与反应过程。
]共同与Cu参与反应过程。【验证】
| 实验序号 | 操作 | 现象 |
| i | 向100mL0.6mol/L的 溶液中加入3g铜粉,振荡静置 溶液中加入3g铜粉,振荡静置 | 蓝色溶液 |
| ii | 向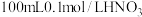 溶液中加入3g铜粉,在密闭容器中反应 溶液中加入3g铜粉,在密闭容器中反应 | 无明显现象 |
| iii | 向100mL0.6mol/L的 溶液[ 溶液[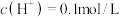 ]中加入3g铜粉,振荡静置 ]中加入3g铜粉,振荡静置 | 深棕色溶液 |
(3)丙同学分析上述三个实验现象认为
 参与反应,其实验证据是
参与反应,其实验证据是 浓度降低,证实
浓度降低,证实 参与反应过程。
参与反应过程。(4)进一步寻找实验iii反应后溶液呈深棕色的原因,丙同学查阅资料得知
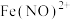 呈棕色,
呈棕色,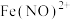 会缓慢分解
会缓慢分解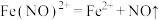 ,推测深棕色产生的反应离子方程式为
,推测深棕色产生的反应离子方程式为 ______
______ _______+______。
_______+______。【结论】
Cu与
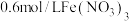 溶液体系首先发生
溶液体系首先发生 氧化Cu的过程,产生
氧化Cu的过程,产生 ,然后
,然后 氧化体系中的
氧化体系中的 ,
, 的还原产物主要以
的还原产物主要以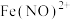 形式存在。
形式存在。
您最近半年使用:0次
名校
10 . 用如图方法回收废旧CPU中的单质 (金)、
(金)、 和
和 。
。 溶解。②
溶解。② :
:
(1)浓、稀 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:________ 。
(2) 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_____ 
②关于溶金的下列说法正确的是_____ 。
A.用到了 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与 也可使
也可使 溶解
溶解
(3)若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为_____  。
。
(4)用适当浓度的盐酸、 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。_____ ,试剂2是_________ 。
 (金)、
(金)、 和
和 。
。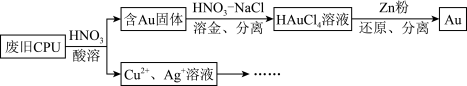
 溶解。②
溶解。② :
:(1)浓、稀
 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(2)
 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了
 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性C.用浓盐酸与
 也可使
也可使 溶解
溶解(3)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为 。
。(4)用适当浓度的盐酸、
 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。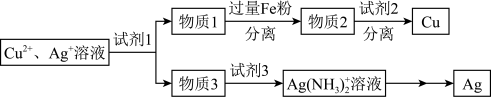
您最近半年使用:0次