名校
解题方法
1 . 某小组探究铜粉与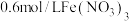 溶液(其中
溶液(其中 )反应可能的化学过程。
)反应可能的化学过程。
【预测】
(1)甲同学认为该体系只发生 氧化Cu单质的反应,离子方程式为
氧化Cu单质的反应,离子方程式为_______ 。
(2)乙同学认为该体系只发生 在酸性条件(
在酸性条件( )下氧化Cu单质的反应,离子方程式为
)下氧化Cu单质的反应,离子方程式为________ 。
丙同学认为该体系为 、
、 [
[ ]共同与Cu参与反应过程。
]共同与Cu参与反应过程。
【验证】
【分析】
(3)丙同学分析上述三个实验现象认为 参与反应,其实验证据是
参与反应,其实验证据是________ 。经实验测定 浓度降低,证实
浓度降低,证实 参与反应过程。
参与反应过程。
(4)进一步寻找实验iii反应后溶液呈深棕色的原因,丙同学查阅资料得知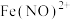 呈棕色,
呈棕色,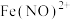 会缓慢分解
会缓慢分解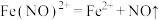 ,推测深棕色产生的反应离子方程式为
,推测深棕色产生的反应离子方程式为______ , ______
______ _______+______。
_______+______。
【结论】
Cu与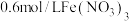 溶液体系首先发生
溶液体系首先发生 氧化Cu的过程,产生
氧化Cu的过程,产生 ,然后
,然后 氧化体系中的
氧化体系中的 ,
, 的还原产物主要以
的还原产物主要以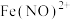 形式存在。
形式存在。
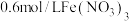 溶液(其中
溶液(其中 )反应可能的化学过程。
)反应可能的化学过程。【预测】
(1)甲同学认为该体系只发生
 氧化Cu单质的反应,离子方程式为
氧化Cu单质的反应,离子方程式为(2)乙同学认为该体系只发生
 在酸性条件(
在酸性条件( )下氧化Cu单质的反应,离子方程式为
)下氧化Cu单质的反应,离子方程式为丙同学认为该体系为
 、
、 [
[ ]共同与Cu参与反应过程。
]共同与Cu参与反应过程。【验证】
| 实验序号 | 操作 | 现象 |
| i | 向100mL0.6mol/L的 溶液中加入3g铜粉,振荡静置 溶液中加入3g铜粉,振荡静置 | 蓝色溶液 |
| ii | 向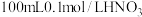 溶液中加入3g铜粉,在密闭容器中反应 溶液中加入3g铜粉,在密闭容器中反应 | 无明显现象 |
| iii | 向100mL0.6mol/L的 溶液[ 溶液[ ]中加入3g铜粉,振荡静置 ]中加入3g铜粉,振荡静置 | 深棕色溶液 |
(3)丙同学分析上述三个实验现象认为
 参与反应,其实验证据是
参与反应,其实验证据是 浓度降低,证实
浓度降低,证实 参与反应过程。
参与反应过程。(4)进一步寻找实验iii反应后溶液呈深棕色的原因,丙同学查阅资料得知
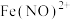 呈棕色,
呈棕色,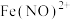 会缓慢分解
会缓慢分解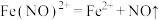 ,推测深棕色产生的反应离子方程式为
,推测深棕色产生的反应离子方程式为 ______
______ _______+______。
_______+______。【结论】
Cu与
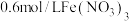 溶液体系首先发生
溶液体系首先发生 氧化Cu的过程,产生
氧化Cu的过程,产生 ,然后
,然后 氧化体系中的
氧化体系中的 ,
, 的还原产物主要以
的还原产物主要以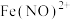 形式存在。
形式存在。
您最近一年使用:0次
名校
解题方法
2 . 铜(过量)与浓硝酸反应,制备少量NaNO3,装置如下图所示。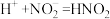 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮
(1)产生的红棕色气体是___________ 。
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)___________ c( )(填“>”或“<”)。
)(填“>”或“<”)。
②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是___________ 。
(3)NaOH溶液吸收NO2、NO。
①
___________
②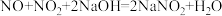
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是 、
、___________ (用化学方程式表示)。
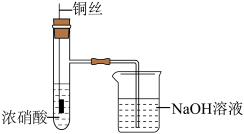
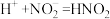 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮(1)产生的红棕色气体是
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)
 )(填“>”或“<”)。
)(填“>”或“<”)。②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是
(3)NaOH溶液吸收NO2、NO。
①

②
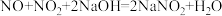
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是
 、
、
您最近一年使用:0次
2023-07-13更新
|
144次组卷
|
2卷引用:北京朝阳区2022-2023学年高一下学期7月期末考试化学试题
3 . 化学小组同学用铜与过量浓硝酸反应制备 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。
(1)甲同学提出猜想:浓硝酸中溶解了生成的 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。
实验:向 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。
甲同学进一步探究硝酸溶液中何种粒子与 作用显黄色。
作用显黄色。
①写出铜和浓硝酸反应产生 的化学方程式
的化学方程式___________ 。
②实验1中溶液a是___________ 。
③依据上述实验推知,浓硝酸中溶液 呈黄色是溶液中
呈黄色是溶液中___________ 与 作用的结果。
作用的结果。
(2)资料:ⅰ.铜与浓硝酸反应过程中可生成 ,
, 易分解产生无色气体
易分解产生无色气体
ⅱ. 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: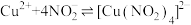 (绿色)
(绿色)
乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成 ,使溶液呈绿色。
,使溶液呈绿色。
实验4: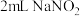 溶液与
溶液与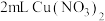 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。
丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应: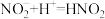 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。
猜想2:酸性条件下 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。
①补全 分解的化学方程式:□
分解的化学方程式:□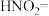 □
□ □___________+□___________
□___________+□______________________
②用离子方程式表示加入 溶液的作用
溶液的作用___________ 。
③丙同学依据实验推知猜想___________ (填“1”或“2”)成立。
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是___________ 。
 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。(1)甲同学提出猜想:浓硝酸中溶解了生成的
 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。实验:向
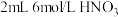 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。甲同学进一步探究硝酸溶液中何种粒子与
 作用显黄色。
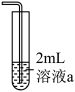
作用显黄色。| 实验装置 | 操作 | 编号 | 溶液a | 现象 |
| 向溶液a中通入稳定的 气流8s 气流8s | 实验1 | ___________ | 溶液基本无色 |
| 实验2 | 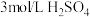 | 立即变黄 | ||
| 实验3 | 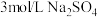 | 溶液基本无色 |
 的化学方程式
的化学方程式②实验1中溶液a是
③依据上述实验推知,浓硝酸中溶液
 呈黄色是溶液中
呈黄色是溶液中 作用的结果。
作用的结果。(2)资料:ⅰ.铜与浓硝酸反应过程中可生成
 ,
, 易分解产生无色气体
易分解产生无色气体ⅱ.
 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: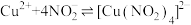 (绿色)
(绿色)乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成
 ,使溶液呈绿色。
,使溶液呈绿色。实验4:
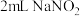 溶液与
溶液与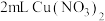 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应:
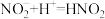 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。猜想2:酸性条件下
 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。| 将实验4中蓝色溶液分成两份 | 加入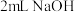 溶液,振荡 溶液,振荡 | 溶液变绿色 |
加入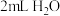 ,振荡 ,振荡 | 溶液仍为蓝色 |
 分解的化学方程式:□
分解的化学方程式:□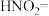 □
□ □___________+□___________
□___________+□___________②用离子方程式表示加入
 溶液的作用
溶液的作用③丙同学依据实验推知猜想
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是
您最近一年使用:0次
2023-07-11更新
|
220次组卷
|
3卷引用:北京市西城区2022-2023学年高一下学期期末测试化学试题
4 . 某小组同学利用下面的实验装置(气密性已检验,试管内预先充满氮气)验证硝酸的性质。
试填空:
(1)步骤i中,红棕色气体是___________ 。
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是___________ 。
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为___________ 。
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由___________ 。
| 实验装置 | 实验步骤 | 实验现象 |
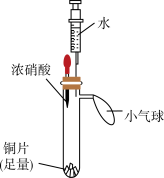 | i.挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
| ii.一段时间后,推动注射器活塞,使水全部进入试管 | 铜片表面产生气泡,溶液变蓝,试管内气体逐渐变为无色 | |
| iii. 试管内气体变为无色后,拉动注射器活塞,吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变为红棕色 |
(1)步骤i中,红棕色气体是
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由
您最近一年使用:0次
名校
5 . 铜粉放入稀硫酸溶液中,加热无明显现象发生,当加入一种盐后,铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,此盐是
| A.NaCl | B.Na2CO3 | C.KNO3 | D.MgCl2 |
您最近一年使用:0次
解题方法
6 . 下列离子方程式书写正确的是
| A.FeCl3腐蚀Cu电路板:2Fe3++Cu=2Fe2++Cu2+ |
B.铜与稀硝酸反应:Cu+4H++NO =Cu2++NO2↑+2H2O =Cu2++NO2↑+2H2O |
C.碳酸钙溶于盐酸中:CO +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| D.氯气通入水中:Cl2+H2O=2H++Cl﹣+ClO﹣ |
您最近一年使用:0次
解题方法
7 . 解释下列事实所用的化学用语不正确 的是
A.酚酞滴入 溶液中,溶液变红: 溶液中,溶液变红: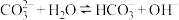 |
B.铜片放入浓硝酸中,产生红棕色气体: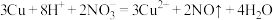 |
C.钢铁发生吸氧腐蚀,负极反应: |
D. 通入溴水中,溶液褪色: 通入溴水中,溶液褪色: |
您最近一年使用:0次
解题方法
8 . 某实验小组探究 与
与 溶液的反应。取
溶液的反应。取 铜粉加入
铜粉加入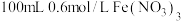 溶液(用
溶液(用 调
调 )中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
已知: 是难溶于水的白色固体
是难溶于水的白色固体
(1)预测铜粉可能发生的反应
反应I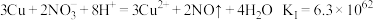
反应II__________________________ 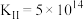
(2)探究反应I是否发生
①取 铜粉加入
铜粉加入
_____________ 溶液中,振荡、静置30分钟,无明显现象。(所用试剂:硝酸钠和硝酸溶液)
②用传感器检测 与
与 溶液反应过程中
溶液反应过程中 浓度的变化,发现
浓度的变化,发现 浓度逐渐减少。有同学认为:
浓度逐渐减少。有同学认为: 催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
ⅰ._____________
ⅱ.反应II
总反应: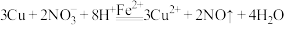
(3)探究反应II是否发生
取 铜粉加入
铜粉加入_____________ 中,溶液迅速变为蓝绿色。取上层清液,滴加 溶液,出现白色浑浊且溶液变红,振荡后红色褪去,
溶液,出现白色浑浊且溶液变红,振荡后红色褪去, 溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因
溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因_____________ 。
(4)分析“溶液呈棕绿色,未见有气泡产生”的原因
小组讨论认为,棕绿色可能是因为 与
与 或
或 形成配合物,设计实验证明棕绿色是
形成配合物,设计实验证明棕绿色是 的颜色,实验操作是
的颜色,实验操作是_____________ 。
(5)从化学反应速率和限度角度简述对 与
与 溶液反应的认识
溶液反应的认识_____________ 。
 与
与 溶液的反应。取
溶液的反应。取 铜粉加入
铜粉加入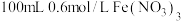 溶液(用
溶液(用 调
调 )中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。已知:
 是难溶于水的白色固体
是难溶于水的白色固体(1)预测铜粉可能发生的反应
反应I
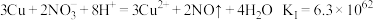
反应II
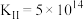
(2)探究反应I是否发生
①取
 铜粉加入
铜粉加入
②用传感器检测
 与
与 溶液反应过程中
溶液反应过程中 浓度的变化,发现
浓度的变化,发现 浓度逐渐减少。有同学认为:
浓度逐渐减少。有同学认为: 催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。ⅰ.
ⅱ.反应II
总反应:
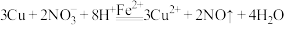
(3)探究反应II是否发生
取
 铜粉加入
铜粉加入 溶液,出现白色浑浊且溶液变红,振荡后红色褪去,
溶液,出现白色浑浊且溶液变红,振荡后红色褪去, 溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因
溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因(4)分析“溶液呈棕绿色,未见有气泡产生”的原因
小组讨论认为,棕绿色可能是因为
 与
与 或
或 形成配合物,设计实验证明棕绿色是
形成配合物,设计实验证明棕绿色是 的颜色,实验操作是
的颜色,实验操作是(5)从化学反应速率和限度角度简述对
 与
与 溶液反应的认识
溶液反应的认识
您最近一年使用:0次
名校
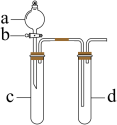
9 . 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。______ 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸。c中的现象是:______ 。再由a向c中加2mL蒸馏水,c中的实验现象是:______ ,离子反应方程式是:______ 。
(3)用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应
②铜与浓硝酸反应
③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应
以下叙述不正确 的是_____ (填字母)。
A.三种途径所消耗铜的质量相等
B.三种途径所消耗硝酸的物质的量①>②>③
C.途径①中被氧化的铜与被还原的硝酸的物质的量之比是3∶2
(4)表格是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是:______ 。理由是:_____ 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸。c中的现象是:
(3)用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应
②铜与浓硝酸反应
③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应
以下叙述
A.三种途径所消耗铜的质量相等
B.三种途径所消耗硝酸的物质的量①>②>③
C.途径①中被氧化的铜与被还原的硝酸的物质的量之比是3∶2
(4)表格是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是:
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
您最近一年使用:0次
2023-01-04更新
|
407次组卷
|
2卷引用:北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷
名校
解题方法
10 . 下列反应的离子方程式书写正确的是
A.碳酸钙与稀盐酸反应:CO +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| B.氯气与NaOH反应:Cl2+2NaOH=2Na++Cl-+ClO-+H2O |
| C.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓ |
D.铜与稀硝酸反应:Cu+4H++2NO =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
您最近一年使用:0次