名校
解题方法
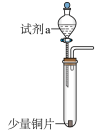
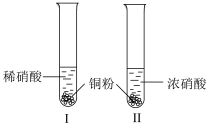
1 . 研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ产生红棕色气体的离子方程式是___________ 。实验Ⅱ产生红棕色气体的化学方程式是___________ 。
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是___________ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
| 装置 | 编号 | 试剂a | 现象 |
| Ⅰ | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体。 |
| Ⅱ | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色。 |
(1)实验Ⅰ产生红棕色气体的离子方程式是
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

 的证据是
的证据是Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
名校
解题方法
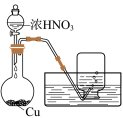
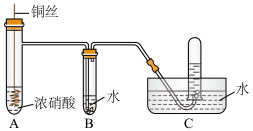
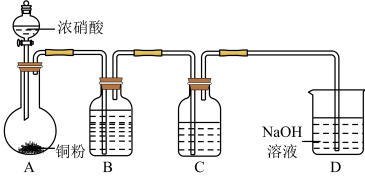
2 . 某同学用稀硝酸和铜反应制NO,发现化学反应速率较慢,因此改用浓硝酸按下图所示装置制取NO。_______ 。
(2)Cu与浓硝酸反应的化学方程式是_______ ,其中硝酸体现酸性和_______ 性。
(3)B中反应的化学方程式是_______ 。
(4)某同学做如下实验,以检验反应中的能量变化。_______ 热反应;(b)中温度降低,由此可以判断(b)中反应是_______ 热反应。
②写出铝与盐酸反应的离子方程式:_______ 。
③根据能量守恒定律,(b)中反应物的总能量应该_______ (填“低于”或“高于”)生成物的总能量。
(2)Cu与浓硝酸反应的化学方程式是
(3)B中反应的化学方程式是
(4)某同学做如下实验,以检验反应中的能量变化。

②写出铝与盐酸反应的离子方程式:
③根据能量守恒定律,(b)中反应物的总能量应该
您最近一年使用:0次
名校
3 . 下列实验室制取气体的方法不合理的是
| A.锌粒与稀硫酸反应制H2 | B.加热浓氨水制NH3 |
| C.铜与浓硝酸反应制NO | D.二氧化锰与浓盐酸共热制Cl2 |
您最近一年使用:0次
2024-04-08更新
|
43次组卷
|
2卷引用:北京市第八十中学2023-2024学年高一下学期3月月考化学试题
名校
4 . 下列实验能达到实验目的的是
| A | B |
|
|
| 制作简单的燃料电池 | 证明苯环使羟基活化 |
| C | D |
|
|
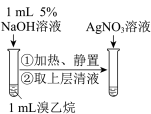
制备并收集 | 检验溴乙烷的水解产物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-23更新
|
125次组卷
|
3卷引用:北京师范大学实验中学2023-2024学年高三上学期12月月考化学试卷
名校
解题方法
5 . 下列离子方程式书写正确的是
| A.铜与硝酸银溶液:Cu + 2Ag+ = Cu2++ 2Ag |
| B.氧化钠溶于水:Na2O + H2O = NaOH |
| C.盐酸溶液中加入铁粉:6H+ + 2Fe = 2Fe3+ + 3H2↑ |
D.碳酸钙和盐酸反应:CO + 2H+ = H2O + CO2↑ + 2H+ = H2O + CO2↑ |
您最近一年使用:0次
名校
6 . 下列叙述不正确 的是
| A.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量固体CuSO4,加快速率 |
| B.在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉溶解 |
| C.向FeCl3溶液中滴加氨水,产生红褐色沉淀;再加入NaHSO4溶液,沉淀消失 |
| D.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
您最近一年使用:0次
2023-10-15更新
|
193次组卷
|
2卷引用:北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
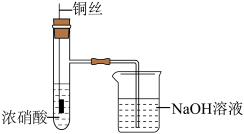
7 . 铜(过量)与浓硝酸反应,制备少量NaNO3,装置如下图所示。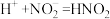 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮
(1)产生的红棕色气体是___________ 。
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)___________ c( )(填“>”或“<”)。
)(填“>”或“<”)。
②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是___________ 。
(3)NaOH溶液吸收NO2、NO。
①
___________
②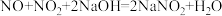
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是 、
、___________ (用化学方程式表示)。
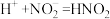 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮(1)产生的红棕色气体是
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)
 )(填“>”或“<”)。
)(填“>”或“<”)。②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是
(3)NaOH溶液吸收NO2、NO。
①

②
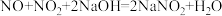
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是
 、
、
您最近一年使用:0次
2023-07-13更新
|
144次组卷
|
2卷引用:北京市陈经纶中学2023-2024学年高一下学期3月月考化学试题
8 . 化学小组同学用铜与过量浓硝酸反应制备 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。
(1)甲同学提出猜想:浓硝酸中溶解了生成的 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。
实验:向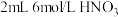 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。
甲同学进一步探究硝酸溶液中何种粒子与 作用显黄色。
作用显黄色。
①写出铜和浓硝酸反应产生 的化学方程式
的化学方程式___________ 。
②实验1中溶液a是___________ 。
③依据上述实验推知,浓硝酸中溶液 呈黄色是溶液中
呈黄色是溶液中___________ 与 作用的结果。
作用的结果。
(2)资料:ⅰ.铜与浓硝酸反应过程中可生成 ,
, 易分解产生无色气体
易分解产生无色气体
ⅱ. 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: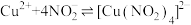 (绿色)
(绿色)
乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成 ,使溶液呈绿色。
,使溶液呈绿色。
实验4: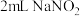 溶液与
溶液与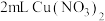 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。
丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应: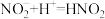 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。
猜想2:酸性条件下 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。
①补全 分解的化学方程式:□
分解的化学方程式:□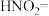 □
□ □___________+□___________
□___________+□______________________
②用离子方程式表示加入 溶液的作用
溶液的作用___________ 。
③丙同学依据实验推知猜想___________ (填“1”或“2”)成立。
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是___________ 。
 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。(1)甲同学提出猜想:浓硝酸中溶解了生成的
 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。实验:向
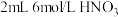 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。甲同学进一步探究硝酸溶液中何种粒子与
 作用显黄色。
作用显黄色。| 实验装置 | 操作 | 编号 | 溶液a | 现象 |
| 向溶液a中通入稳定的 气流8s 气流8s | 实验1 | ___________ | 溶液基本无色 |
| 实验2 | 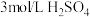 | 立即变黄 | ||
| 实验3 | 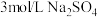 | 溶液基本无色 |
 的化学方程式
的化学方程式②实验1中溶液a是
③依据上述实验推知,浓硝酸中溶液
 呈黄色是溶液中
呈黄色是溶液中 作用的结果。
作用的结果。(2)资料:ⅰ.铜与浓硝酸反应过程中可生成
 ,
, 易分解产生无色气体
易分解产生无色气体ⅱ.
 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: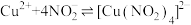 (绿色)
(绿色)乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成
 ,使溶液呈绿色。
,使溶液呈绿色。实验4:
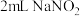 溶液与
溶液与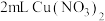 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应:
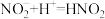 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。猜想2:酸性条件下
 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。| 将实验4中蓝色溶液分成两份 | 加入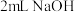 溶液,振荡 溶液,振荡 | 溶液变绿色 |
加入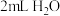 ,振荡 ,振荡 | 溶液仍为蓝色 |
 分解的化学方程式:□
分解的化学方程式:□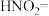 □
□ □___________+□___________
□___________+□___________②用离子方程式表示加入
 溶液的作用
溶液的作用③丙同学依据实验推知猜想
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是
您最近一年使用:0次
2023-07-11更新
|
220次组卷
|
3卷引用: 北京市第五中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
9 . 某学习小组探究稀 、浓
、浓 与铜的反应。
与铜的反应。
(1)试管Ⅰ中Cu与稀 反应的化学方程式是
反应的化学方程式是___________ 。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是___________ 。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1: 的浓度较大所致;
的浓度较大所致;
假设2:溶解了生成的 。
。
探究如下:取Ⅱ中绿色溶液,分为两等份。
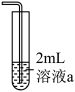
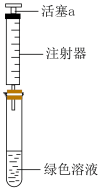
①取一份置于如图所示装置中,___________ (填“操作”和“现象”),证实Ⅱ中溶解了 。
。
②向另一份溶液加入___________ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀 与铜生成NO、浓
与铜生成NO、浓 与铜生成
与铜生成 的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
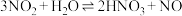
①B中盛放的试剂是___________ 。
②C中盛放 和
和___________ 。
③该小组证实推测的合理性所依据的实验现象是___________ 。
 、浓
、浓 与铜的反应。
与铜的反应。| 装置(尾气处理装置略) | 现象 |
 | Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
| Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
 反应的化学方程式是
反应的化学方程式是(2)Ⅱ中反应的速率比Ⅰ中的快,原因是
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:
 的浓度较大所致;
的浓度较大所致;假设2:溶解了生成的
 。
。探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份置于如图所示装置中,
 。
。
②向另一份溶液加入
(4)对于稀
 与铜生成NO、浓
与铜生成NO、浓 与铜生成
与铜生成 的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。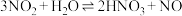

①B中盛放的试剂是
②C中盛放
 和
和③该小组证实推测的合理性所依据的实验现象是
您最近一年使用:0次
名校
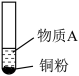
10 . 小组同学探究 和物质A的反应,实验如下。
和物质A的反应,实验如下。
下列分析不正确 的是
 和物质A的反应,实验如下。
和物质A的反应,实验如下。| 装置 | 序号 | 物质A | 实验现象 |
| ① |  溶液(调 溶液(调 ) ) | 铜粉溶解,溶液变为深棕色[经检验含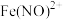 ] ] |
| ② | 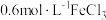 溶液 溶液 | 铜粉溶解,溶液变为蓝绿色 | |
| ③ | 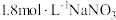 溶液(调 溶液(调 ) ) | 无明显变化 |
A.②中铜粉溶解的原因: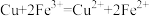 |
B.①中产生 的原因: 的原因: 时直接将 时直接将 还原为 还原为 |
C.若向③中加入 固体,推测铜粉会溶解 固体,推测铜粉会溶解 |
| D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关 |
您最近一年使用:0次
2023-05-07更新
|
1421次组卷
|
15卷引用:北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题
北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市第一○一中学2023-2024学年高三上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题北京市八一学校2023-2024学年高一下学期3月月考化学试题北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题北京市第二中学2023-2024学年高三下学期开学考试化学试卷(已下线)第7讲 金属材料和金属矿物利用(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷(已下线)热点19 化学微型实验