解题方法
1 . 某小组同学探究铜和浓硝酸的反应,进行如下实验:
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
(1)写出铜和浓硝酸反应的离子反应方程式:______ 。
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:______ 。
(3)取⑤中溶液,______ (填操作和现象),证实猜想2成立。
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
结合上述实验现象,下列推测合理的是______ (填字母序号)。
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O HNO3+HNO2(慢)
HNO3+HNO2(慢)
反应2:2HNO2 NO2+NO+H2O(快)
NO2+NO+H2O(快)
解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因______ 。
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
①实验中加入的固体物质可能是______ (写出一种,填化学式)。
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,______ ,______ 。
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:
(3)取⑤中溶液,
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
| 通入气体 | 氮气 | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,25min后溶液变为蓝色 | 液面上方出现明显的红棕色气体,5min后溶液变为蓝色 |
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O
 HNO3+HNO2(慢)
HNO3+HNO2(慢)反应2:2HNO2
 NO2+NO+H2O(快)
NO2+NO+H2O(快)解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
| 加入物质 | ______固体 | 3滴30%H2O2溶液 | 3滴水 |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,
您最近一年使用:0次
名校
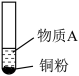
2 . 小组同学探究 和物质A的反应,实验如下。
和物质A的反应,实验如下。
下列分析不正确 的是
 和物质A的反应,实验如下。
和物质A的反应,实验如下。| 装置 | 序号 | 物质A | 实验现象 |
| ① | 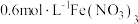 溶液(调 溶液(调 ) ) | 铜粉溶解,溶液变为深棕色[经检验含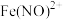 ] ] |
| ② | 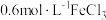 溶液 溶液 | 铜粉溶解,溶液变为蓝绿色 | |
| ③ | 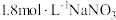 溶液(调 溶液(调 ) ) | 无明显变化 |
A.②中铜粉溶解的原因: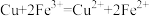 |
B.①中产生 的原因: 的原因: 时直接将 时直接将 还原为 还原为 |
C.若向③中加入 固体,推测铜粉会溶解 固体,推测铜粉会溶解 |
| D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关 |
您最近一年使用:0次
2023-05-07更新
|
1421次组卷
|
15卷引用:北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题
北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市第一○一中学2023-2024学年高三上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题北京市第二中学2023-2024学年高三下学期开学考试化学试卷北京市八一学校2023-2024学年高一下学期3月月考化学试题(已下线)第7讲 金属材料和金属矿物利用(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷(已下线)热点19 化学微型实验
名校
解题方法
3 . 下列关于铜腐蚀的说法及方程式书写正确的是
A.铜在潮湿空气中被腐蚀: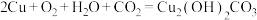 |
B.铜在 环境中被腐蚀: 环境中被腐蚀: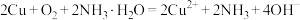 |
C. 浓度越大,腐蚀反应 浓度越大,腐蚀反应 速率越大 速率越大 |
D.利用 对铜的腐蚀制作印刷线路板: 对铜的腐蚀制作印刷线路板: |
您最近一年使用:0次
2023-03-30更新
|
625次组卷
|
4卷引用:北京市朝阳区2023届高三一模考试化学试题
解题方法
4 . 某化学小组探究铜和稀硝酸的反应:
资料1 铜与浓度低于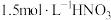 反应很慢,且放热极少。
反应很慢,且放热极少。
(1)实验预测
①铜与稀 反应的离子方程式为
反应的离子方程式为_______ 。
②小组同学预测铜与稀 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是_______ 。
(2)实验实施
实验I:铜丝与 反应。
反应。
实验II:探究Cu与稀 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:
资料2:
i.上述溶液中均不存在-3价的氮; 为淡黄色沉淀。
为淡黄色沉淀。
ii. 是一种弱酸,
是一种弱酸, ;
;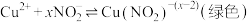
①通过上述实验,证明铜与稀 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是_______ 。
②分析阶段B溶液呈绿色的原因_______ 。
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因_______ 。
④写出铜和稀 反应的生成
反应的生成 的化学方程式
的化学方程式_______ 。
(3)继续探究:
探究铜和稀 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
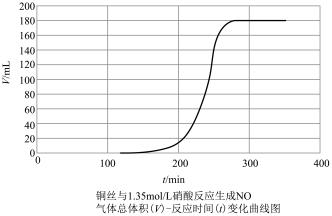
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为_______ 。
(4)反思总结:通过上述实验探究过程,铜和 的反应实际过程可能为
的反应实际过程可能为_______ 。
资料1 铜与浓度低于
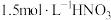 反应很慢,且放热极少。
反应很慢,且放热极少。(1)实验预测
①铜与稀
 反应的离子方程式为
反应的离子方程式为②小组同学预测铜与稀
 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是(2)实验实施
实验I:铜丝与
 反应。
反应。| 实验装置 | 实验操作 | 实验现象 |
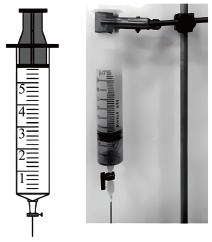 | 在洁净的注射器中装入已活化铜丝2.3g,再用注射器抽取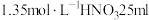 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 反应体系处于无氧环境中。 反应体系处于无氧环境中。 | 反应较慢阶段A:反应前90min几乎没有现象,90min左右才有很少气泡产生(该气体遇空气变成红棕色),溶液为浅蓝色;反应较快阶段B:之后溶液逐渐变为绿色;最后阶段C:在反应结束前15min左右时,体系溶液为深蓝色。 |
 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:操作及现象 实验序号 | 取不同阶段的溶液进行实验操作 | 实验现象 | ||
| 阶段A溶液 | 阶段B溶液 | 阶段C溶液 | ||
| 1 | 滴加 酸性 酸性 溶液 溶液 | 褪色,滴6滴后溶液不褪色 | 褪色,但滴20滴后溶液仍然褪色 | 褪色,滴10滴后溶液不再褪色 |
| 2 | 滴加3% 溶液 溶液 | 无明显现象 | 少量淡黄色沉淀 | 较多黄色沉淀 |
| 3 | 滴加稀 溶液 溶液 | 无明显现象 | 变蓝色 | 无明显现象 |
i.上述溶液中均不存在-3价的氮;
 为淡黄色沉淀。
为淡黄色沉淀。ii.
 是一种弱酸,
是一种弱酸, ;
;
①通过上述实验,证明铜与稀
 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是②分析阶段B溶液呈绿色的原因
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因
④写出铜和稀
 反应的生成
反应的生成 的化学方程式
的化学方程式(3)继续探究:
探究铜和稀
 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物
 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为(4)反思总结:通过上述实验探究过程,铜和
 的反应实际过程可能为
的反应实际过程可能为
您最近一年使用:0次
2023-01-09更新
|
763次组卷
|
4卷引用:北京市顺义区2023届高三第一次统练化学试题
名校
5 . 某同学进行如下实验:
下列说法不正确 的是
| 实验 | 实验现象 | |
| ⅰ | 将铜粉加入试管中,再加入稀 | 溶液变蓝,液面上方呈浅红棕色;至不再产生气泡时,铜粉有剩余,余液呈酸性 |
| ⅱ | 继续向ⅰ中试管加入少量固体 | 又产生气泡,铜粉减少,液面上方呈浅红棕色 |
| ⅲ | 取饱和 溶液,加入少量固体 溶液,加入少量固体 和铜粉 和铜粉 | 无明显变化 |
A. 氧化性的强弱与其浓度大小有关 氧化性的强弱与其浓度大小有关 |
| B.ⅰ、ⅱ中铜粉减少的原因能用相同的离子反应解释 |
C.ⅰ中余液呈酸性的主要原因是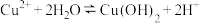 |
D.用一定浓度的 与 与 也能使铜粉溶解 也能使铜粉溶解 |
您最近一年使用:0次
2022-05-19更新
|
832次组卷
|
7卷引用:北京市朝阳区2022届高三 二模化学试题
北京市朝阳区2022届高三 二模化学试题北京市东城区第五中学2022届高三三模化学试题北京市通州区2022届高三下学期三模考试化学试题福建省福州第三中学2023届高三下学期5月第十七次质量检测化学试题北京大学附属中学2021-2022学年高二下学期期末考试化学试卷(已下线)1.3.2 氧化性、还原性强弱的判断(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)第10讲 金属材料及金属矿物的开发利用(练)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
6 . 某实验小组在研究硝酸与铜的反应时,发现稀硝酸和铜反应后的混合液为蓝色,而浓硝酸和铜反应后的混合液为绿色,为此对产生绿色的原因开展探究。按要求完成下列问题:
[猜想假设]
(1)假设1:___________
假设2:硝酸铜溶液中溶解了
[实验操作及现象分析]
实验一:向蒸馏水中不断加入硝酸铜晶体,最终配成饱和溶液。配制过程中溶液颜色始终是蓝色,未见绿色出现。
甲同学根据实验一的现象证明了假设1不成立,请补全假设。
实验二:
(2)甲同学在实验一的基础上继续开展了实验二,并初步验证了假设2成立,他的实验操作及现象是___________ 。
乙同学认为假设2不严谨,用以下实验对假设2进行了深入探究:
实验三:
(3)结合实验三,乙同学认为假设2不严谨的证据是___________
(4)乙同学查阅资料发现:
①铜与浓硝酸反应后溶液呈现绿色是由于 (或
(或 )与铜离子作用的结果。
)与铜离子作用的结果。
②金属和浓 的反应一旦发生后速率不断加快。原因是过程中有
的反应一旦发生后速率不断加快。原因是过程中有 生成。如
生成。如 和浓
和浓 反应,开始生成的
反应,开始生成的 溶于水形成
溶于水形成 ,它再和
,它再和 反应,速率就大大加快。
反应,速率就大大加快。
请依据资料完成以下离子反应方程式。
i.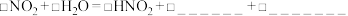 ;
;___________
ii. ;
;___________
iii.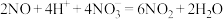
实验四:乙同学通过以下实验证实了反应过程中 的生成。
的生成。
(5)结合化学用语,解释实验3产生该现象的原因是___________ 。
[猜想假设]
(1)假设1:
假设2:硝酸铜溶液中溶解了

[实验操作及现象分析]
实验一:向蒸馏水中不断加入硝酸铜晶体,最终配成饱和溶液。配制过程中溶液颜色始终是蓝色,未见绿色出现。
甲同学根据实验一的现象证明了假设1不成立,请补全假设。
实验二:
(2)甲同学在实验一的基础上继续开展了实验二,并初步验证了假设2成立,他的实验操作及现象是
乙同学认为假设2不严谨,用以下实验对假设2进行了深入探究:
实验三:
| 操作及试剂 | 现象 |
向浓硝酸和铜反应后的混合液中通入 | 大量红棕色气体放出,短时间内溶液仍保持绿色。长时间后变成蓝色 |
(4)乙同学查阅资料发现:
①铜与浓硝酸反应后溶液呈现绿色是由于
 (或
(或 )与铜离子作用的结果。
)与铜离子作用的结果。②金属和浓
 的反应一旦发生后速率不断加快。原因是过程中有
的反应一旦发生后速率不断加快。原因是过程中有 生成。如
生成。如 和浓
和浓 反应,开始生成的
反应,开始生成的 溶于水形成
溶于水形成 ,它再和
,它再和 反应,速率就大大加快。
反应,速率就大大加快。请依据资料完成以下离子反应方程式。
i.
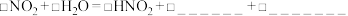 ;
;ii.
 ;
;iii.
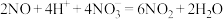
实验四:乙同学通过以下实验证实了反应过程中
 的生成。
的生成。| 实验 | 操作 | 现象 |
| 1 | 向试管a中加入lmL浓硝酸,再插入铜丝 | 快速产生红棕色气体,溶液变为绿色 |
| 2 | 向试管b中加入1mL浓硝酸,3滴蒸馏水,再插入铜丝 | 快速产生红棕色气体溶液变为绿色 |
| 3 | 向试管c中加入1mL浓硝酸,3滴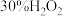 ,再插入铜丝 ,再插入铜丝 | 反应较慢,溶液变为蓝色 |
您最近一年使用:0次
2022-03-31更新
|
702次组卷
|
3卷引用:北京市房山区2022届高三一模化学试题
名校
解题方法
7 . 同学们探究不同金属和浓硫酸的反应。向三等份浓硫酸中分别加入大小相同的不同金属片,加热,用生成气体进行下表实验操作并记录实验现象。
已知: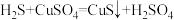 (CuS为黑色固体);
(CuS为黑色固体); 可燃
可燃
下列说法不正确 的是
| 实验操作 | 实验现象 | ||
| 金属为铜 | 金属为锌 | 金属为铝 | |
| 点燃 | 不燃烧 | 燃烧 | 燃烧 |
通入 酸性溶液 酸性溶液 | 褪色 | 褪色 | 褪色 |
通入 溶液 溶液 | 无明显变化 | 无明显变化 | 出现黑色沉淀 |
| 通入品红溶液 | 褪色 | 褪色 | 不褪色 |
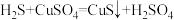 (CuS为黑色固体);
(CuS为黑色固体); 可燃
可燃下列说法
A.加入铜片的实验中,使 酸性溶液褪色的气体是 酸性溶液褪色的气体是 |
B.加入铝片的实验中,燃烧现象能证明生成气体中一定含 |
| C.加入锌片的实验中,生成的气体一定是混合气体 |
| D.金属与浓硫酸反应的还原产物与金属活动性强弱有关 |
您最近一年使用:0次
2021-05-10更新
|
1531次组卷
|
16卷引用:北京市海淀区2021届高三二模化学试题
北京市海淀区2021届高三二模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(02)北京市房山区2022-2023学年高三二模化学试题北京市中国人民大学附属中学2023-2024学年高三下学期一模模拟化学试题北京首都师范大学附属中学2021-2022学年高三上学期10月月考化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京市第八十中学2023-2024学年高一下学期期中考试化学(选考)试题(已下线)第13讲 硫及其化合物(精练)-2022年高考化学一轮复习讲练测(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练辽宁省沈阳市东北育才学校2021-2022学年高三上学期学段考试化学试题趋势4 创新探究类实验(已下线)第四章 非金属及其化合物 第21练 硫酸 含硫物质的转化广东省广州市番禺中学2022-2023学年高一下学期4月期中考试化学试题云南省昆明市第一中学2022-2023学年高一下学期期中考试化学试题(已下线)第4讲 浓硫酸 不同价态含硫物质的转化
名校
解题方法
8 . 某校化学小组同学研究 Cu与H2SO4 溶液反应,小伟同学实验记录如下:
(1)实验一:探究白雾的成分
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式________ 。
②艳艳同学认为不妥,补充实验Ⅲ:
根据实验Ⅲ,可推断白雾成分是______ ,而并非SO2。
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
【资料】Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式_______ 。
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,__________ 。
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了______ 。
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
①实验Ⅴ的目的是 ______ 。
②通过以上实验,臧臧同学得出的结论是______ 。
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 取螺旋状铜丝在酒精灯上烧至红热,迅速伸入装有 10 mL 3 mol/L H2SO4溶液的试管中 | 产生大量白雾;溶液颜色变为浅蓝色;试管中出现红色浑浊 |
| Ⅱ | 步骤一:取螺旋状铜丝在酒精灯上烧至红热, 迅速伸入装有10 mL蒸馏水的试管中; 步骤二:冷却后加入5 mL 3 mol/L H2SO4 | 步骤一:产生少量白雾;试管中出现黑色浑浊,略带红色 步骤二:浑浊全部为红色;溶液略显蓝色 |
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式
②艳艳同学认为不妥,补充实验Ⅲ:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅲ | 步骤一:取品红溶液,加 3 mol/L H2SO4溶液,加热; 步骤二:收集实验Ⅰ中白雾,加入品红溶液,加热 | 步骤一:溶液褪色,加热无颜色变化; 步骤二:溶液褪色,加热无颜色变化 |
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
【资料】Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅳ | 取Cu2O固体少量,加入到装有 10 mL3 mol/L H2SO4 溶液的试管中 | 溶液迅速变为蓝色;试管中出现少量亮红色固体 |
| Ⅴ | 取Cu2O固体少量,加入到装有 10 mL 3 mol/L H2SO4 和少量CuSO4 (浅蓝色)的试管中 | 现象同Ⅳ |
| Ⅵ | 重复实验Ⅰ,振荡试管,分为两等份。第一份立刻加入浓硫酸至 c(H2SO4)=3 mol/L;第二份静置 4 h之后,过滤,向固体中加入浓硫酸至 c(H2SO4)=3 mol/L | 第一份加酸后红色固体明显减少,溶液蓝色加深;第二份静置时,固体减少,溶液缓慢变为蓝色,固体加酸后无明显现象。 |
②通过以上实验,臧臧同学得出的结论是
您最近一年使用:0次
名校
解题方法
9 . 某小组同学用如图装置进行铜与浓硫酸反应时,发现试管中有黑色物质产生。同学猜测,黑色物质中可能含有CuO、Cu2S和CuS,针对产生的黑色物质,该小组同学继续进行实验探究,获得数据如表。下列说法不正确 的是
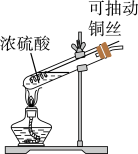
| 硫酸浓度/ mol·L﹣1 | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
| A.硫酸浓度越大,黑色物质越易出现、越难消失 |
| B.黑色物质消失过程中有SO2、H2S生成 |
| C.硫酸浓度为16 mol·L﹣1时,先升温至250℃以上,再将铜丝与浓硫酸接触,可以避免产生黑色物质 |
| D.取黑色物质洗涤、干燥后,加稀硫酸充分混合,固体质量不变,说明黑色物质中不含CuO |
您最近一年使用:0次
2020-06-06更新
|
385次组卷
|
2卷引用:北京市丰台区2020届高三下学期高三综合练习(二)化学试题
名校
10 . 下列各项比较中,一定相等的是( )
| A.相同物质的量Cu分别与足量浓硝酸和稀硝酸反应,生成气体的物质的量 |
| B.相同物质的量的Na2O和Na2O2中所含阴离子的数目 |
| C.相同质量的Fe分别与足量Cl2、S充分反应,转移的电子数 |
| D.相同物质的量浓度的NH4Cl和NH4HCO3溶液中的c(NH4+) |
您最近一年使用:0次
2020-05-07更新
|
166次组卷
|
3卷引用:北京市石景山区2020届高三第一次模拟化学试题
北京市石景山区2020届高三第一次模拟化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学与生活 氧化还原反应 阿伏加德罗常数北京市第二中学2023-2024学年高三上学期12月月考化学试题