名校
解题方法
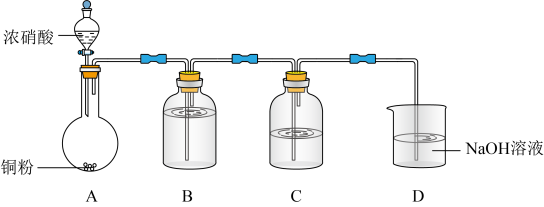
1 . 将足量SO2通入AgNO3溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热,夹持等装置略)。
资料:i.Ag2SO4微溶于水;Ag2SO3难溶于水。
ii.Ag2SO4、Ag2SO3均溶于氨水。___________ 。
②B的作用是___________ 。
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
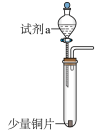
推测白色沉淀(t1)可能为Ag2SO4、Ag2SO3或混合物。探究如下:
①试剂a是___________ 。
②产生白色沉淀Y的原因是___________ 。
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤,洗涤。向洗净的沉淀中加入浓HNO3,证实沉淀含Ag。现象是___________ 。
(4)通过检测 探究产生Ag的原因。
探究产生Ag的原因。
①实验:___________ 。(用化学方程式表示)
②t1时,C中产生白色沉淀的离子方程式是___________ 。
综上可知,化学反应的产物与反应速率有关。
资料:i.Ag2SO4微溶于水;Ag2SO3难溶于水。
ii.Ag2SO4、Ag2SO3均溶于氨水。
②B的作用是
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
| 时间 | 反应开始时(t1) | 一段时间后(t2) | 较长时间后(t3) |
| 颜色 | 白色 | 灰黑色 | 灰黑色加深 |

①试剂a是
②产生白色沉淀Y的原因是
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤,洗涤。向洗净的沉淀中加入浓HNO3,证实沉淀含Ag。现象是
(4)通过检测
 探究产生Ag的原因。
探究产生Ag的原因。①实验:
 (已排除O2的影响)
(已排除O2的影响)
②t1时,C中产生白色沉淀的离子方程式是
综上可知,化学反应的产物与反应速率有关。
您最近一年使用:0次
名校
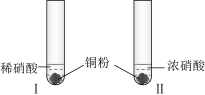
2 . 某学习小组探究稀HNO3、浓HNO3与铜的反应。
(1)试管I中Cu与稀HNO3反应的离子方程式是_______ 。
(2)II中反应的速率比I中的快,原因是_______ 。
(3)针对II中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取II中绿色溶液,分为两等份。
①取一份加入如图所示装置中,_______ (填“操作”和“现象”),证实II中溶解了NO2。_______ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1:HNO3;浓度越稀,溶液中 的数目越少,被还原时,每个
的数目越少,被还原时,每个 从还原剂处获得较多电子的机会
从还原剂处获得较多电子的机会_______ (填“增多”或“减少”),因此被还原为更低价态。
解释2:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
实验验证浓硝酸能将NO氧化成NO2,实验装置如下图:_______ 。
②C中盛放 和
和_______ 。
③该小组证实推测的合理性所依据的实验现象是_______ 。
装置(尾气处理装置略) | 现象 |
| I中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
| II中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管I中Cu与稀HNO3反应的离子方程式是
(2)II中反应的速率比I中的快,原因是
(3)针对II中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取II中绿色溶液,分为两等份。
①取一份加入如图所示装置中,

(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1:HNO3;浓度越稀,溶液中
 的数目越少,被还原时,每个
的数目越少,被还原时,每个 从还原剂处获得较多电子的机会
从还原剂处获得较多电子的机会解释2:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
实验验证浓硝酸能将NO氧化成NO2,实验装置如下图:
②C中盛放
 和
和③该小组证实推测的合理性所依据的实验现象是
您最近一年使用:0次
名校
解题方法
3 . 研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ产生红棕色气体的离子方程式是___________ 。实验Ⅱ产生红棕色气体的化学方程式是___________ 。
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是___________ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
| 装置 | 编号 | 试剂a | 现象 |
| Ⅰ | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体。 |
| Ⅱ | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色。 |
(1)实验Ⅰ产生红棕色气体的离子方程式是
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

 的证据是
的证据是Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
名校
解题方法
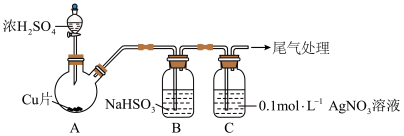
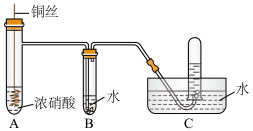
4 . 某同学用稀硝酸和铜反应制NO,发现化学反应速率较慢,因此改用浓硝酸按下图所示装置制取NO。_______ 。
(2)Cu与浓硝酸反应的化学方程式是_______ ,其中硝酸体现酸性和_______ 性。
(3)B中反应的化学方程式是_______ 。
(4)某同学做如下实验,以检验反应中的能量变化。_______ 热反应;(b)中温度降低,由此可以判断(b)中反应是_______ 热反应。
②写出铝与盐酸反应的离子方程式:_______ 。
③根据能量守恒定律,(b)中反应物的总能量应该_______ (填“低于”或“高于”)生成物的总能量。
(2)Cu与浓硝酸反应的化学方程式是
(3)B中反应的化学方程式是
(4)某同学做如下实验,以检验反应中的能量变化。

②写出铝与盐酸反应的离子方程式:
③根据能量守恒定律,(b)中反应物的总能量应该
您最近一年使用:0次
名校
解题方法
5 . 某小组探究铜粉与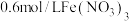 溶液(其中
溶液(其中 )反应可能的化学过程。
)反应可能的化学过程。
【预测】
(1)甲同学认为该体系只发生 氧化Cu单质的反应,离子方程式为
氧化Cu单质的反应,离子方程式为_______ 。
(2)乙同学认为该体系只发生 在酸性条件(
在酸性条件( )下氧化Cu单质的反应,离子方程式为
)下氧化Cu单质的反应,离子方程式为________ 。
丙同学认为该体系为 、
、 [
[ ]共同与Cu参与反应过程。
]共同与Cu参与反应过程。
【验证】
【分析】
(3)丙同学分析上述三个实验现象认为 参与反应,其实验证据是
参与反应,其实验证据是________ 。经实验测定 浓度降低,证实
浓度降低,证实 参与反应过程。
参与反应过程。
(4)进一步寻找实验iii反应后溶液呈深棕色的原因,丙同学查阅资料得知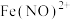 呈棕色,
呈棕色,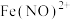 会缓慢分解
会缓慢分解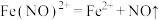 ,推测深棕色产生的反应离子方程式为
,推测深棕色产生的反应离子方程式为______ , ______
______ _______+______。
_______+______。
【结论】
Cu与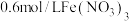 溶液体系首先发生
溶液体系首先发生 氧化Cu的过程,产生
氧化Cu的过程,产生 ,然后
,然后 氧化体系中的
氧化体系中的 ,
, 的还原产物主要以
的还原产物主要以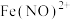 形式存在。
形式存在。
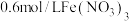 溶液(其中
溶液(其中 )反应可能的化学过程。
)反应可能的化学过程。【预测】
(1)甲同学认为该体系只发生
 氧化Cu单质的反应,离子方程式为
氧化Cu单质的反应,离子方程式为(2)乙同学认为该体系只发生
 在酸性条件(
在酸性条件( )下氧化Cu单质的反应,离子方程式为
)下氧化Cu单质的反应,离子方程式为丙同学认为该体系为
 、
、 [
[ ]共同与Cu参与反应过程。
]共同与Cu参与反应过程。【验证】
| 实验序号 | 操作 | 现象 |
| i | 向100mL0.6mol/L的 溶液中加入3g铜粉,振荡静置 溶液中加入3g铜粉,振荡静置 | 蓝色溶液 |
| ii | 向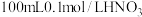 溶液中加入3g铜粉,在密闭容器中反应 溶液中加入3g铜粉,在密闭容器中反应 | 无明显现象 |
| iii | 向100mL0.6mol/L的 溶液[ 溶液[ ]中加入3g铜粉,振荡静置 ]中加入3g铜粉,振荡静置 | 深棕色溶液 |
(3)丙同学分析上述三个实验现象认为
 参与反应,其实验证据是
参与反应,其实验证据是 浓度降低,证实
浓度降低,证实 参与反应过程。
参与反应过程。(4)进一步寻找实验iii反应后溶液呈深棕色的原因,丙同学查阅资料得知
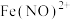 呈棕色,
呈棕色,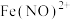 会缓慢分解
会缓慢分解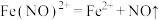 ,推测深棕色产生的反应离子方程式为
,推测深棕色产生的反应离子方程式为 ______
______ _______+______。
_______+______。【结论】
Cu与
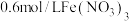 溶液体系首先发生
溶液体系首先发生 氧化Cu的过程,产生
氧化Cu的过程,产生 ,然后
,然后 氧化体系中的
氧化体系中的 ,
, 的还原产物主要以
的还原产物主要以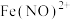 形式存在。
形式存在。
您最近一年使用:0次
名校
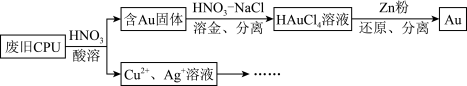
6 . 用如图方法回收废旧CPU中的单质 (金)、
(金)、 和
和 。
。 溶解。②
溶解。② :
:
(1)浓、稀 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:________ 。
(2) 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_____ 
②关于溶金的下列说法正确的是_____ 。
A.用到了 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与 也可使
也可使 溶解
溶解
(3)若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为_____  。
。
(4)用适当浓度的盐酸、 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。_____ ,试剂2是_________ 。
 (金)、
(金)、 和
和 。
。
 溶解。②
溶解。② :
:(1)浓、稀
 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(2)
 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了
 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性C.用浓盐酸与
 也可使
也可使 溶解
溶解(3)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为 。
。(4)用适当浓度的盐酸、
 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。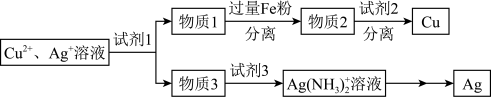
您最近一年使用:0次
解题方法
7 . 某小组同学探究铜和浓硝酸的反应,进行如下实验:
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
(1)写出铜和浓硝酸反应的离子反应方程式:______ 。
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:______ 。
(3)取⑤中溶液,______ (填操作和现象),证实猜想2成立。
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
结合上述实验现象,下列推测合理的是______ (填字母序号)。
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O HNO3+HNO2(慢)
HNO3+HNO2(慢)
反应2:2HNO2 NO2+NO+H2O(快)
NO2+NO+H2O(快)
解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因______ 。
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
①实验中加入的固体物质可能是______ (写出一种,填化学式)。
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,______ ,______ 。
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:
(3)取⑤中溶液,
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
| 通入气体 | 氮气 | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,25min后溶液变为蓝色 | 液面上方出现明显的红棕色气体,5min后溶液变为蓝色 |
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O
 HNO3+HNO2(慢)
HNO3+HNO2(慢)反应2:2HNO2
 NO2+NO+H2O(快)
NO2+NO+H2O(快)解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
| 加入物质 | ______固体 | 3滴30%H2O2溶液 | 3滴水 |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,
您最近一年使用:0次
名校
解题方法
8 . 铜(过量)与浓硝酸反应,制备少量NaNO3,装置如下图所示。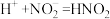 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮
(1)产生的红棕色气体是___________ 。
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)___________ c( )(填“>”或“<”)。
)(填“>”或“<”)。
②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是___________ 。
(3)NaOH溶液吸收NO2、NO。
①
___________
②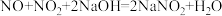
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是 、
、___________ (用化学方程式表示)。
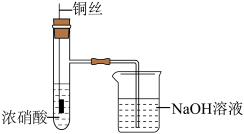
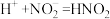 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮(1)产生的红棕色气体是
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)
 )(填“>”或“<”)。
)(填“>”或“<”)。②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是
(3)NaOH溶液吸收NO2、NO。
①

②
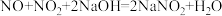
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是
 、
、
您最近一年使用:0次
2023-07-13更新
|
144次组卷
|
2卷引用:北京朝阳区2022-2023学年高一下学期7月期末考试化学试题
9 . 化学小组同学用铜与过量浓硝酸反应制备 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。
(1)甲同学提出猜想:浓硝酸中溶解了生成的 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。
实验:向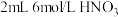 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。
甲同学进一步探究硝酸溶液中何种粒子与 作用显黄色。
作用显黄色。
①写出铜和浓硝酸反应产生 的化学方程式
的化学方程式___________ 。
②实验1中溶液a是___________ 。
③依据上述实验推知,浓硝酸中溶液 呈黄色是溶液中
呈黄色是溶液中___________ 与 作用的结果。
作用的结果。
(2)资料:ⅰ.铜与浓硝酸反应过程中可生成 ,
, 易分解产生无色气体
易分解产生无色气体
ⅱ. 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: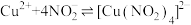 (绿色)
(绿色)
乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成 ,使溶液呈绿色。
,使溶液呈绿色。
实验4: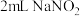 溶液与
溶液与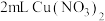 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。
丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应: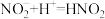 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。
猜想2:酸性条件下 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。
①补全 分解的化学方程式:□
分解的化学方程式:□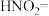 □
□ □___________+□___________
□___________+□______________________
②用离子方程式表示加入 溶液的作用
溶液的作用___________ 。
③丙同学依据实验推知猜想___________ (填“1”或“2”)成立。
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是___________ 。
 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。(1)甲同学提出猜想:浓硝酸中溶解了生成的
 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。实验:向
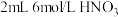 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。甲同学进一步探究硝酸溶液中何种粒子与
 作用显黄色。
作用显黄色。| 实验装置 | 操作 | 编号 | 溶液a | 现象 |
| 向溶液a中通入稳定的 气流8s 气流8s | 实验1 | ___________ | 溶液基本无色 |
| 实验2 | 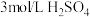 | 立即变黄 | ||
| 实验3 | 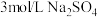 | 溶液基本无色 |
 的化学方程式
的化学方程式②实验1中溶液a是
③依据上述实验推知,浓硝酸中溶液
 呈黄色是溶液中
呈黄色是溶液中 作用的结果。
作用的结果。(2)资料:ⅰ.铜与浓硝酸反应过程中可生成
 ,
, 易分解产生无色气体
易分解产生无色气体ⅱ.
 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: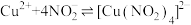 (绿色)
(绿色)乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成
 ,使溶液呈绿色。
,使溶液呈绿色。实验4:
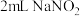 溶液与
溶液与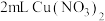 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应:
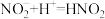 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。猜想2:酸性条件下
 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。| 将实验4中蓝色溶液分成两份 | 加入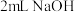 溶液,振荡 溶液,振荡 | 溶液变绿色 |
加入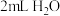 ,振荡 ,振荡 | 溶液仍为蓝色 |
 分解的化学方程式:□
分解的化学方程式:□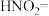 □
□ □___________+□___________
□___________+□___________②用离子方程式表示加入
 溶液的作用
溶液的作用③丙同学依据实验推知猜想
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是
您最近一年使用:0次
2023-07-11更新
|
220次组卷
|
3卷引用:北京市西城区2022-2023学年高一下学期期末测试化学试题
10 . 某小组同学利用下面的实验装置(气密性已检验,试管内预先充满氮气)验证硝酸的性质。
试填空:
(1)步骤i中,红棕色气体是___________ 。
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是___________ 。
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为___________ 。
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由___________ 。
| 实验装置 | 实验步骤 | 实验现象 |
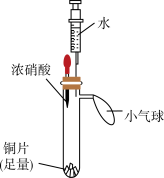 | i.挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
| ii.一段时间后,推动注射器活塞,使水全部进入试管 | 铜片表面产生气泡,溶液变蓝,试管内气体逐渐变为无色 | |
| iii. 试管内气体变为无色后,拉动注射器活塞,吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变为红棕色 |
(1)步骤i中,红棕色气体是
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由
您最近一年使用:0次