名校
解题方法
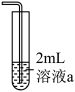
1 . 某小组探究铜粉与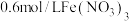 溶液(其中
溶液(其中 )反应可能的化学过程。
)反应可能的化学过程。
【预测】
(1)甲同学认为该体系只发生 氧化Cu单质的反应,离子方程式为
氧化Cu单质的反应,离子方程式为_______ 。
(2)乙同学认为该体系只发生 在酸性条件(
在酸性条件( )下氧化Cu单质的反应,离子方程式为
)下氧化Cu单质的反应,离子方程式为________ 。
丙同学认为该体系为 、
、 [
[ ]共同与Cu参与反应过程。
]共同与Cu参与反应过程。
【验证】
【分析】
(3)丙同学分析上述三个实验现象认为 参与反应,其实验证据是
参与反应,其实验证据是________ 。经实验测定 浓度降低,证实
浓度降低,证实 参与反应过程。
参与反应过程。
(4)进一步寻找实验iii反应后溶液呈深棕色的原因,丙同学查阅资料得知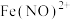 呈棕色,
呈棕色,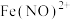 会缓慢分解
会缓慢分解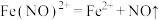 ,推测深棕色产生的反应离子方程式为
,推测深棕色产生的反应离子方程式为______ , ______
______ _______+______。
_______+______。
【结论】
Cu与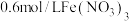 溶液体系首先发生
溶液体系首先发生 氧化Cu的过程,产生
氧化Cu的过程,产生 ,然后
,然后 氧化体系中的
氧化体系中的 ,
, 的还原产物主要以
的还原产物主要以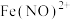 形式存在。
形式存在。
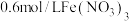 溶液(其中
溶液(其中 )反应可能的化学过程。
)反应可能的化学过程。【预测】
(1)甲同学认为该体系只发生
 氧化Cu单质的反应,离子方程式为
氧化Cu单质的反应,离子方程式为(2)乙同学认为该体系只发生
 在酸性条件(
在酸性条件( )下氧化Cu单质的反应,离子方程式为
)下氧化Cu单质的反应,离子方程式为丙同学认为该体系为
 、
、 [
[ ]共同与Cu参与反应过程。
]共同与Cu参与反应过程。【验证】
| 实验序号 | 操作 | 现象 |
| i | 向100mL0.6mol/L的 溶液中加入3g铜粉,振荡静置 溶液中加入3g铜粉,振荡静置 | 蓝色溶液 |
| ii | 向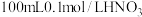 溶液中加入3g铜粉,在密闭容器中反应 溶液中加入3g铜粉,在密闭容器中反应 | 无明显现象 |
| iii | 向100mL0.6mol/L的 溶液[ 溶液[ ]中加入3g铜粉,振荡静置 ]中加入3g铜粉,振荡静置 | 深棕色溶液 |
(3)丙同学分析上述三个实验现象认为
 参与反应,其实验证据是
参与反应,其实验证据是 浓度降低,证实
浓度降低,证实 参与反应过程。
参与反应过程。(4)进一步寻找实验iii反应后溶液呈深棕色的原因,丙同学查阅资料得知
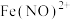 呈棕色,
呈棕色,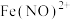 会缓慢分解
会缓慢分解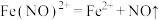 ,推测深棕色产生的反应离子方程式为
,推测深棕色产生的反应离子方程式为 ______
______ _______+______。
_______+______。【结论】
Cu与
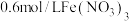 溶液体系首先发生
溶液体系首先发生 氧化Cu的过程,产生
氧化Cu的过程,产生 ,然后
,然后 氧化体系中的
氧化体系中的 ,
, 的还原产物主要以
的还原产物主要以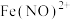 形式存在。
形式存在。
您最近一年使用:0次
名校
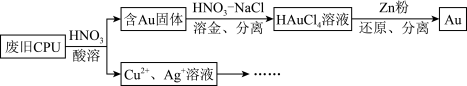
2 . 用如图方法回收废旧CPU中的单质 (金)、
(金)、 和
和 。
。 溶解。②
溶解。② :
:
(1)浓、稀 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:________ 。
(2) 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_____ 
②关于溶金的下列说法正确的是_____ 。
A.用到了 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与 也可使
也可使 溶解
溶解
(3)若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为_____  。
。
(4)用适当浓度的盐酸、 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。_____ ,试剂2是_________ 。
 (金)、
(金)、 和
和 。
。
 溶解。②
溶解。② :
:(1)浓、稀
 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(2)
 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了
 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性C.用浓盐酸与
 也可使
也可使 溶解
溶解(3)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为 。
。(4)用适当浓度的盐酸、
 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。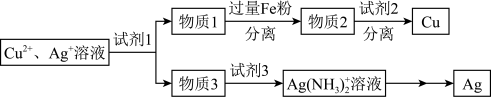
您最近一年使用:0次
名校
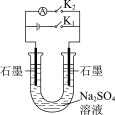
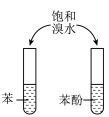
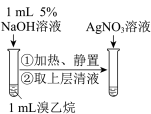
3 . 下列实验能达到实验目的的是
| A | B |
|
|
| 制作简单的燃料电池 | 证明苯环使羟基活化 |
| C | D |
|
|
制备并收集 | 检验溴乙烷的水解产物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-23更新
|
125次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
4 . 下列离子方程式书写正确的是
| A.铜与硝酸银溶液:Cu + 2Ag+ = Cu2++ 2Ag |
| B.氧化钠溶于水:Na2O + H2O = NaOH |
| C.盐酸溶液中加入铁粉:6H+ + 2Fe = 2Fe3+ + 3H2↑ |
D.碳酸钙和盐酸反应:CO + 2H+ = H2O + CO2↑ + 2H+ = H2O + CO2↑ |
您最近一年使用:0次
名校
5 . 下列叙述不正确 的是
| A.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量固体CuSO4,加快速率 |
| B.在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉溶解 |
| C.向FeCl3溶液中滴加氨水,产生红褐色沉淀;再加入NaHSO4溶液,沉淀消失 |
| D.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
您最近一年使用:0次
2023-10-15更新
|
193次组卷
|
2卷引用:北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题
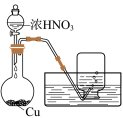
6 . 化学小组同学用铜与过量浓硝酸反应制备 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。
(1)甲同学提出猜想:浓硝酸中溶解了生成的 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。
实验:向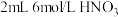 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。
甲同学进一步探究硝酸溶液中何种粒子与 作用显黄色。
作用显黄色。
①写出铜和浓硝酸反应产生 的化学方程式
的化学方程式___________ 。
②实验1中溶液a是___________ 。
③依据上述实验推知,浓硝酸中溶液 呈黄色是溶液中
呈黄色是溶液中___________ 与 作用的结果。
作用的结果。
(2)资料:ⅰ.铜与浓硝酸反应过程中可生成 ,
, 易分解产生无色气体
易分解产生无色气体
ⅱ. 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: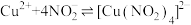 (绿色)
(绿色)
乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成 ,使溶液呈绿色。
,使溶液呈绿色。
实验4: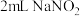 溶液与
溶液与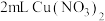 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。
丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应: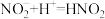 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。
猜想2:酸性条件下 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。
①补全 分解的化学方程式:□
分解的化学方程式:□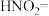 □
□ □___________+□___________
□___________+□______________________
②用离子方程式表示加入 溶液的作用
溶液的作用___________ 。
③丙同学依据实验推知猜想___________ (填“1”或“2”)成立。
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是___________ 。
 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。(1)甲同学提出猜想:浓硝酸中溶解了生成的
 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。实验:向
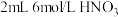 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。甲同学进一步探究硝酸溶液中何种粒子与
 作用显黄色。
作用显黄色。| 实验装置 | 操作 | 编号 | 溶液a | 现象 |
| 向溶液a中通入稳定的 气流8s 气流8s | 实验1 | ___________ | 溶液基本无色 |
| 实验2 | 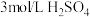 | 立即变黄 | ||
| 实验3 | 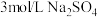 | 溶液基本无色 |
 的化学方程式
的化学方程式②实验1中溶液a是
③依据上述实验推知,浓硝酸中溶液
 呈黄色是溶液中
呈黄色是溶液中 作用的结果。
作用的结果。(2)资料:ⅰ.铜与浓硝酸反应过程中可生成
 ,
, 易分解产生无色气体
易分解产生无色气体ⅱ.
 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: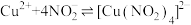 (绿色)
(绿色)乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成
 ,使溶液呈绿色。
,使溶液呈绿色。实验4:
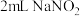 溶液与
溶液与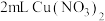 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应:
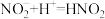 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。猜想2:酸性条件下
 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。| 将实验4中蓝色溶液分成两份 | 加入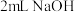 溶液,振荡 溶液,振荡 | 溶液变绿色 |
加入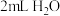 ,振荡 ,振荡 | 溶液仍为蓝色 |
 分解的化学方程式:□
分解的化学方程式:□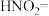 □
□ □___________+□___________
□___________+□___________②用离子方程式表示加入
 溶液的作用
溶液的作用③丙同学依据实验推知猜想
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是
您最近一年使用:0次
2023-07-11更新
|
217次组卷
|
3卷引用:北京市西城区2022-2023学年高一下学期期末测试化学试题
名校
解题方法
7 . 下列方程式不能 表示相应变化的是
A.氢氧化钾在水中电离: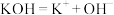 |
B.氯气与氢氧化钠溶液反应: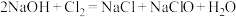 |
C.石灰石与稀盐酸反应: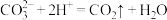 |
D.铜与浓硝酸反应: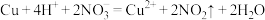 |
您最近一年使用:0次
2023-05-23更新
|
70次组卷
|
2卷引用:北京市回民学校2022-2023学年高一下学期期中考试化学试题
名校
8 . 在100mL混合溶液中,HNO3和H2SO4物质的量浓度分别为0.4mol·L-1和0.1mol·L-1,向该溶液中加入1.92g铜粉,待充分反应后,所得溶液中Cu2+物质的量浓度(mol·L-1)为(溶液体积变化忽略不计)
| A.0.3 | B.0.225 | C.0.6 | D.0.45 |
您最近一年使用:0次
2023-05-10更新
|
732次组卷
|
57卷引用:北京市第五中学2021-2022学年高一下学期期中考试化学试题
北京市第五中学2021-2022学年高一下学期期中考试化学试题(已下线)2011届江西省南昌市铁路一中高三12月月考化学试卷(已下线)2011届安徽省阜阳三中高三上学期期末考试化学试卷(已下线)2011-2012学年天津市耀华中学高一上学期期末考试化学试卷(已下线)2012届陕西省西安中学高三第三次月考化学试卷(已下线)2012年苏教版高中化学必修1 4.2生产生活中的含氮化合物练习卷(已下线)2014-2015学年湖南省衡阳八中高三上学期第二次月考化学试卷(已下线)2015届山东省莱州市第一中学高三10月月考化学试卷(已下线)2015届山东省莱州市一中高三10月月考化学试卷2015届陕西省宝鸡中学高三上学期12月月考理综化学试卷(A)2015-2016学年黑龙江大庆实验中学高二下期末化学试卷2016-2017学年山东省济南市历城区第二中学高一下学期开学考试化学试卷2016-2017学年四川省绵阳南山中学高一下学期3月月考化学试卷湖北省宜昌市示范高中协作体2016-2017学年高一下学期期中联考化学试题福建省莆田市第一中学2016-2017学年高一下学期期中考试化学试题河北省邢台市第一中学2017-2018学年高一下学期开学考试化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高一下学期第一次月考化学试题黑龙江省哈尔滨市第三中学2017-2018学年高一下学期第一次月考化学试题内蒙古鄂尔多斯市第一中学2017-2018学年高一下学期第一次月考化学试题山东省莒县第一中学2018-2019学年高一上学期12月月考化学试题新疆维吾尔自治区生产建设兵团第一师高级中学2018-2019学年高一上学期期末考试化学试题云南省玉溪市江川区第二中学2018-2019学年高一下学期开学考试化学试题河南省郑州第四十七中2019-2020学年高一上学期第二次月考化学试题2020届高三化学二轮冲刺新题专练——金属及金属化合物的性质(选择专练)人教版(2019)必修第二册第五章第二节 易错疑难集训重庆市育才中学2019-2020学年高一下学期3月月考化学试题四川省绵阳南山中学实验学校2019-2020学年高一下学期开学考试化学试题河北省邯郸市馆陶县第一中学2019-2020学年高一下学期期中考试化学试卷黑龙江省海林市朝鲜族中学2019-2020学年高二下学期期末考试化学试题湖南省长沙市雨花区2017-2018学年高一下学期期末考试化学试题鲁科版(2019)高一必修第一册第三章易错疑难集训(三)必修第二册RJ第5章第二节 氮及其化合物 易错疑难集训(二)(已下线)小题必刷20 氮及其化合物——2021年高考化学一轮复习小题必刷(通用版)安徽省马鞍山市和县2020-2021学年高一上学期期中联考化学试题山西省实验中学2019届高三上学期第二次月考化学试题(已下线)【浙江新东方】高中化学20210429—009【2021】【高一下】吉林省“BEST合作体”2020-2021学年高一下学期期中化学试题(已下线)【浙江新东方】在线化学93高一下黑龙江省牡丹江市海林市朝鲜族中学 2020-2021学年高二5月月考化学试题(苏教版2019)必修第二册专题7 氮与社会可持续发展 易错疑难集训黑龙江省绥化市肇东四中2020-2021学年高一下学期期末考试化学试题甘肃省嘉峪关市第一中学2021届高三上学期三模考试化学试题(已下线)【苏州新东方】园区星海2020-2021学年高一下学期月考广东省广州市第六中学2021-2022学年高一下学期期中考试化学试题上海市实验学校2021-2022学年高三下学期4月月考化学试题广东省广州市第六中学2021-2022学年高一下学期期中考试化学试题吉林省长春市第二实验中学 2021-2022 学年高一下学期期中考试化学试题浙江省舟山市普陀中学2023届高三返校考试化学试题浙江省舟山市舟山中学2022-2023学年国庆返校检测高三化学试题(已下线)【2022】【高一下】【长河】【期中考】【高中化学】【张明涛收集】(已下线)题型62 金属与HNO3反应的规律和相关计算湖南省永州市东安县第一中学2022-2023学年高一下学期开年摸底联考化学试题山西省大同市第一中学2022-2023学年高一下学期3月考试化学试题四川省眉山市仁寿县第一中学2022-2023学年高一下学期3月月考化学试题四川省仁寿第一中学校南校区2022-2023学年高一下学期3月月考化学试题辽宁省 大连育明高级中学2022-2023学年高一下学期期中考试化学试题河南省商丘市第一高级中学2022-2023学年高二下学期期末考试化学试题
名校
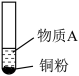
9 . 小组同学探究 和物质A的反应,实验如下。
和物质A的反应,实验如下。
下列分析不正确 的是
 和物质A的反应,实验如下。
和物质A的反应,实验如下。| 装置 | 序号 | 物质A | 实验现象 |
| ① | 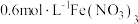 溶液(调 溶液(调 ) ) | 铜粉溶解,溶液变为深棕色[经检验含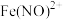 ] ] |
| ② | 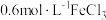 溶液 溶液 | 铜粉溶解,溶液变为蓝绿色 | |
| ③ | 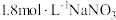 溶液(调 溶液(调 ) ) | 无明显变化 |
A.②中铜粉溶解的原因: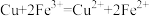 |
B.①中产生 的原因: 的原因: 时直接将 时直接将 还原为 还原为 |
C.若向③中加入 固体,推测铜粉会溶解 固体,推测铜粉会溶解 |
| D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关 |
您最近一年使用:0次
2023-05-07更新
|
1419次组卷
|
15卷引用:北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题
北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市第一○一中学2023-2024学年高三上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题北京市第二中学2023-2024学年高三下学期开学考试化学试卷北京市八一学校2023-2024学年高一下学期3月月考化学试题(已下线)第7讲 金属材料和金属矿物利用(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷(已下线)热点19 化学微型实验
名校
10 . 铜粉放入稀硫酸溶液中,加热无明显现象发生,当加入一种盐后,铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,此盐是
| A.NaCl | B.Na2CO3 | C.KNO3 | D.MgCl2 |
您最近一年使用:0次